
| A. | 电解质本身不一定能导电 | |
| B. | 溶液中离子数越多,导电性就越强 | |
| C. | 溶于水后能电离出H+的化合物都是酸 | |
| D. | 电解质在水溶液里或熔融状态下能够导电,说明电解质本身必须含有阴阳离子 |
分析 A、电解质是一种化合物在水溶液中或熔融状态下若能电离出自由移动离子而导电,则此化合物为电解质;
B、溶液的导电性取决于离子浓度;
C、电离出的阳离子全部是氢离子的化合物为酸;
D、电解质可以是共价化合物,也可以是离子化合物.
解答 解:A、电解质是一种化合物在水溶液中或熔融状态下若能电离出自由移动离子而导电,则此化合物为电解质,故电解质本身不一定能导电,但溶于水或熔融状态下一定能导电,故A正确;
B、溶液的导电性取决于离子浓度,和离子个数无关,故B错误;
C、电离出的阳离子全部是氢离子的化合物为酸,即能电离出氢离子的化合物不一定是酸,故C错误;
D、若电解质在熔融状态下能导电,则此化合物为离子化合物,由阴阳离子构成;但若一种电解质在水溶液中能导电,则此化合物不一定是离子化合物,可能为共价化合物,故D错误.
故选A.
点评 本题考查了电解质与导电性的关系,应注意的是电解质不一定能导电,能导电的不一定是电解质.


科目:高中化学 来源: 题型:选择题
| A. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| B. | NH4Cl固体中混有少量的I2,可用加热的方法将I2除去 | |
| C. | 用浓硫酸吸收二氧化硫中混有少量SO3气体 | |
| D. | 少量金属锂保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为NaHSO4是电解质,因此固体NaHSO4能够导电 | |
| B. | NaHSO4固体中阳离子和阴离子的个数比是2:1 | |
| C. | NaHSO4固体熔化时破坏的是离子键和共价键 | |
| D. | NaHSO4固体溶于水时既破坏离子键又破坏共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅和金刚石的物理性质相似 | |
| B. | 硅在地壳中含量居第二位,可以以游离态存在于自然界中 | |
| C. | 晶体硅是一种良好的半导体材料,但是它提炼工艺复杂,价格昂贵 | |
| D. | 晶体硅具有金属光泽,故它属于金属材料,可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用相同 | |
| B. | 晶体的熔点由高到低排列顺序为SiO2、CsCl、CBr4、CF4 | |
| C. | 1molNaCl中有NA个NaCl分子 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
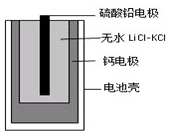 热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向钙电极移动 | |
| C. | 外电路中,电子由硫酸铅电极经导线流向钙电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com