
����Ŀ��NiSO4xH2O��һ����ɫ������ˮ�ľ��壬�㷺���ڶ�������صȣ����ɵ�Ʒ����������⣬������ͭ��п������Ԫ�أ�Ϊԭ�ϻ�ã�����������ͼ�� 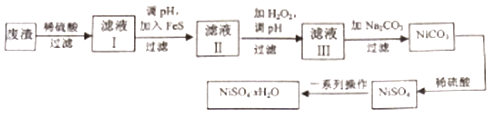
��1���ڴ��Ƽ��϶���ʱ�����Ƽ�Ӧ��������ƹ����е������ҺŨ�� �����������С���������䡱��
��2������Һ���м���FeS��Ϊ�˳�ȥCu2+��Zn2+�����ʣ����ȥCu2+�����ӷ���ʽΪ �� ��Zn2+ǡ�ó�����ȫʱ����CuS��ZnS����Ļ��Һ��c��Zn2+��=10��5mol/L����c��Cu2+��=mol/L ����֪Ksp��CuS��=1.3��10��36 �� Ksp��ZnS��=1.6��10��24����
��3������Һ�����ȼ�H2O2�ٵ�pH����pH��Ŀ���� ��
��4����Һ�����ʵ���Ҫ�ɷ���NiSO4 �� ����Na2CO3���˺��ټ�����ϡ�����ܽ�������NiSO4 �� ������������Ŀ���� ��
��5��Ϊ�ⶨNiSO4xH2O����x��ֵ����ȡ26.3g�����������ȫʧȥ�ᾧˮ��ʣ�����15.5g����x��ֵ���� ��
���𰸡�
��1����������
��2��FeS��aq��+Cu2+��aq��=Fe2+��aq��+CuS��aq����8.1��10��18
��3����ȥFe3+
��4������NiSO4��Ũ��,���������ᾧ����NiSO4��
��5��6
���������⣺��1���ڴ��Ƽ��϶��������Ƽ����������Ʋ���������������������Һ�������ӵ�����Һ���������������������ܽ�����������ʵ������Һ��Ũ�Ȳ��䣻
���Դ��ǣ��������䣻��2������Һ���м���FeS��ҪĿ���dz�ȥCu��Zn�����ʣ�˵��CuS���ܽ�ȸ�С����Ӧ�����ӷ���ʽΪFeS��aq��+Cu2+��aq��=Fe2+��aq��+CuS��aq����
��֪Ksp��CuS��=1.3��10��36��Ksp��ZnS��=1.6��10��24����Zn2+ǡ�ó�����ȫʱ����CuS��ZnS����Ļ��Һ��c��Zn2+��=10��5mol/L������Һ�е�c��S2����= ![]() =
= ![]() =1.6��10��19mol/L����c��Cu2+��=
=1.6��10��19mol/L����c��Cu2+��= ![]() =
= ![]() mol/L��8.1��10��18 mol/L��
mol/L��8.1��10��18 mol/L��
���Դ��ǣ�FeS��aq��+Cu2+��aq��=Fe2+��aq��+CuS��aq����8.1��10��18����3������Һ���ȼӹ������⣬������Fe2+����Fe3+������pH������ˮ����������������������ȥ��
���Դ��ǣ���ȥ Fe3+����4����Һ�����ʵ���Ҫ�ɷ���NiSO4���ټ���̼���ƹ��˺�ϡ�����ܽ�������NiSO4���������NiSO4Ũ�ȣ������������ᾧ��
���Դ��ǣ�����NiSO4��Ũ�ȣ����������ᾧ������NiSO4������5��26.3g�����������ȫʧȥ�ᾧˮ��ʣ�����15.5g��ʧȥˮ������=26.3g��15.5g=10.8g��NiSO4������Ϊ15.5g���������ʵ����õ�1��x= ![]() ��
�� ![]() �����x=6��
�����x=6��
���Դ��ǣ�6��


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ʒӵ�һ�ֺϳ�·����ͼ�� 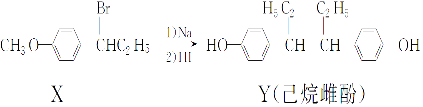
����������ȷ���ǣ�������
A.��NaOH ˮ��Һ�м��ȣ�������X �ɷ�����ȥ��Ӧ
B.��һ�������£�������Y����Ũ��ˮ����ȡ����Ӧ
C.��FeCl3��Һ���ܼ�����X��Y
D.������Y�в���������̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����(����)
A. �ɱ�����ʱ̼������������ B. CaO��SiO2�����ж������ڵ���С����
C. Na2O��Na2O2�����Ļ�ѧ��������ȫ��ͬ D. Br2������ľ̿����ʱ���ۼ����ƻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҵ���Է�ˮ��NO3-�ĵ��ع���ԭ����ͼ��ʾ������ܷ�ӦΪ4NO3-+4H+![]() 2N2��+5O2��+2H2O������˵����ȷ����
2N2��+5O2��+2H2O������˵����ȷ����
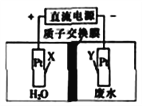
A. X�缫�Ϸ�����ԭ��Ӧ
B. Y�缫�Ϸ����ĵ缫��ӦΪ2NO3-+10e-+12H+==N2��+6H2O
C. ���ع���ʱ��H+�����ӽ���Ĥ�Ҳ�������ƶ�
D. ���ع���ʱ����·��ÿͨ��2mol���ӣ�����15.68L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.û�е��ʲμӵĻ��Ϸ�ӦҲ������������ԭ��Ӧ
B.���е������ɵĻ�ѧ��Ӧһ����������ԭ��Ӧ
C.������ֻ�ܵõ��ӱ���ԭ��������ֻ��ʧ���ӱ�����
D.��������������ԭ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaOH��Һ�����ڶ�������Ĵ�����
��1��CO2���������壬����NaOH��Һ���յõ�Na2CO3��NaHCO3 �� ��Na2CO3�׳ƴ����CO32��ˮ���ʹ��ˮ��Һ�ʼ��ԣ�д��CO32����һ��ˮ������ӷ���ʽ �� ��֪25��ʱ��CO32����һ��ˮ���ƽ�ⳣ��Kh=2��10��4mol/L������Һ��c��HCO3������c��CO32����=20��1 ʱ����Һ��pH= ��
����ĭ�������ͨ��װ��NaHCO��Һ��Al2��SO4��3��Һ����д����������Һ���ʱ�����ӷ�Ӧ����ʽ ��
��2��������Ũ���ᷴӦ������NO2����NaOH��Һ���գ���Ӧ����ʽΪ��2NO2+2NaOH=NaNO3+NaNO2+H2O����0.2molNaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ҺBΪ0��1molL��1CH3COONa��Һ����������Һ��c��NO3������c��NO2������c��CH3COO�����ɴ�С��˳��Ϊ����֪HNO2�ĵ��볣��Ka=7.1��10��4molL��1 �� CH3COOH�ĵ��볣��Ka=1.7��10��5molL��1������ʹ��ҺA����ҺB�� pH��ȵķ����� �� A������ҺA�м�����NaOH B������ҺA�м�����ˮ
C������ҺB�м�����NaOH D������ҺB�м�����ˮ
��3�������е�SO2���������꣬����������������Һ���գ�����SO2�Ĺ����У���Һ��H2SO3��HSO3����SO32��������ռ���ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ�� 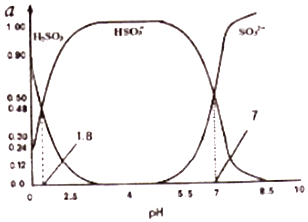
��ͼ��pH=7ʱ����Һ������Ũ�ȹ�ϵ��ȷ���� ��
A��c��Na+����2c��SO32������c��HSO3����
B��c��Na+��=c��SO32�� ��+c��HSO3����+c��H2SO3��
C��c��OH����=c��H+��+c��H2SO3��+c��HSO3����
D��c��Na+����c��HSO3������c��SO32�� ����c��H+��=c��OH����
��������ͼ�����ݣ���ӦH2SO3=2H++SO32����ƽ�ⳣ������ֵ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪ������Ԫ�أ������ڱ���������λ������ͼ��ʾ��A��C����Ԫ�ص�ԭ�Ӻ��������֮�͵���Bԭ�ӵ���������Bԭ�Ӻ�������������������ȣ�
A | C | |
D | B | E |
��1��д������Ԫ������A________��B _______��C_______��
��2��BԪ��λ��Ԫ�����ڱ��е�______���ڣ�_______�塣
��3���Ƚ�B��D��E����Ԫ�ص�����������ˮ����������ǿ���ǣ��û�ѧʽ��ʾ��______��
��4��Cԭ�ӽṹʾ��ͼΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������pH=2�Ĵ�����Һ��pH=2�������ң���������в���������⣺
��1��ȡ10mL�ļ���Һ������������ˮ������ĵ���ƽ��������������ҡ��������ƶ�����ȡ10mL�ļ���Һ������������ˮ�����ƹ��壨����������ǰ����Һ������ֲ��䣩���������������Һ�� ![]() �ı�ֵ�������������С������ȷ��������
�ı�ֵ�������������С������ȷ��������
��2����ͬ�����£�ȡ������ļס�������Һ����ϡ��100����ϡ�ͺ����Һ����pH��С��ϵΪ��pH���ף�pH���ң���������ڡ�����С�ڡ����ڡ�����ͬ��
��3����ȡ25mL�ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�к���pH=7�������ĵ�NaOH��Һ�������С��ϵΪ��V���ף�V���ң���
��4��ȡ25mL�ļ���Һ����������pH=12��NaOH��Һ����Ӧ����Һ��[Na+]��[CH3COO��]�Ĵ�С��ϵΪ��[Na+][CH3COO��]��
��5��ȡ25mL������Һ����������pH=12�İ�ˮ����Ӧ����Һ�е�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ����ķ�����ᴿ�������õķ����У��ٹ��ˡ�����������������ȡ���ݼ��ȷֽ�ȣ����и������ķ�����ᴿӦ����ʲô������������ţ�
��1����ȡ��ˮ�еĵ� ��
��2����ȥʳ����Һ�е�ˮ ��
��3��������ˮ ��
��4����ȥKC1�����к��е�����KClO3 ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com