
(11分)右图所示为相互串联的甲、乙两电解池,试回答:
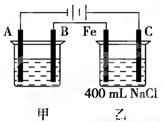
⑴若甲池利用电解原理在铁上镀银,则A电极材料是________,电极反应式是________________,B是_______极,应选用的电解质溶液是________ ;
⑵乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____ 色,
C极附近呈_______色;
⑶若甲池阴极增重43.2 g,则乙池中阳极上放出的气体在标况下的体积是________mL;
⑷若乙池中剩余溶液仍为400 mL,则电解后所得NaOH溶液的物质的量浓度为________mol/L,pH等于
________。
(1)铁;Ag++e-=Ag;阳;AgNO3 (2)红;无 (3)4480 (4)1;14
【解析】
试题分析:(1)电镀是待镀金属做阴极,和电源和负极相连。镀层金属做阳极,和电源的正极相连,含有镀层金属离子的溶液做电镀液。若甲池利用电解原理在铁上镀银,则A电极材料是铁,溶液中的银离子在负极得到电子,电极反应式是Ag++e-=Ag。B是阳极,应选用的电解质溶液是硝酸银溶液。
(2)乙池中铁电极和电源的负极相连,做阴极,溶液中的氢离子放电,所以铁电极负极水的电离平衡被破坏,溶液显碱性,即溶液呈红色。碳棒和电源的正极相连,做阳极,溶液中的离子放电生成氯气,所以碳棒附近溶液呈无色。
(3)甲池阴极增重43.2 g,这说明析出的单质银是43.2g,物质的量是0.4mol,转移0.4mol电子。乙池中阳极是氯离子放电,则根据电子的得失守恒可知,生成氯气的物质的量是0.4mol÷2=0.2mol,因此在标准状况下的体积是4.48L。
(4)根据反应的方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑,生成的氯气是0.2mol,所以氢氧化钠是0.4mol,则氢氧化钠溶液的浓度是0.4mol÷0.4L=1.0mol/L,则pH=14。
2NaOH+H2↑+Cl2↑,生成的氯气是0.2mol,所以氢氧化钠是0.4mol,则氢氧化钠溶液的浓度是0.4mol÷0.4L=1.0mol/L,则pH=14。
考点:考查电解池的有关判断、电极反应式的书写以及有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确电解池的工作原理,然后灵活运用即可。


科目:高中化学 来源:2012—2013学年广西省柳铁一中高二下学期第一次月考化学试卷(带解析) 题型:填空题
(11分)右图所示为相互串联的甲、乙两电解池,试回答: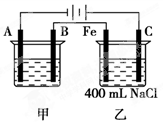
⑴若甲池利用电解原理在铁上镀银,则A电极材料是________,电极反应式是________________,B是_______极,应选用的电解质溶液是________ ;
⑵乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____ 色,
C极附近呈_______色;
⑶若甲池阴极增重43.2 g,则乙池中阳极上放出的气体在标况下的体积是________mL;
⑷若乙池中剩余溶液仍为400 mL,则电解后所得NaOH溶液的物质的量浓度为________mol/L,pH等于
________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com