
【题目】不能由两种单质直接化合制得物质是
A. FeCl3 B. FeS C. FeCl2 D. Fe3O4
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
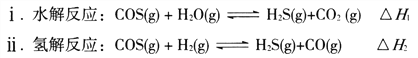
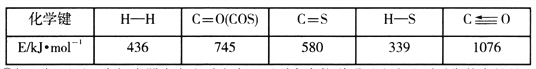
已知反应中相关的化学键键能数据如下表:
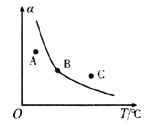
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
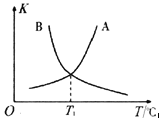
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为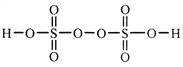
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法不正确的是
A.苯分子中所有原子在同一平面上B.苯燃烧火焰明亮伴有浓烈的黑烟
C.苯中无碳碳双键,故不能发生加成反应D.苯可发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
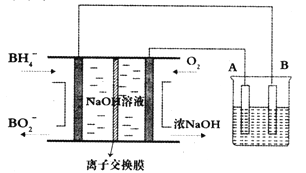
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O
C. 电解池中的电解质溶液可以选择CuSO4溶液
D. 每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用硝酸酸化的AgNO3 溶液可鉴别NaCl、 NaBr、 KI 三种溶液
B. 可用饱和NaCl溶液除去Cl2中的HCl 气体
C. 用加热方法可除去Na2CO3固体中的NaHCO3
D. 可用饱和Na2CO3溶液除去CO2中的HCl 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 核外电子排布相同的微粒化学性质也相同
B. Cl与Cl得电子能力相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O![]() 2HI+H2SO4
2HI+H2SO4
②2FeCl3+2HI![]() 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
③3FeCl2+4HNO3![]() 2FeCl+NO+2H2O+Fe(NO3)3
2FeCl+NO+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+>NO B. I->Fe2+>H2SO3>NO C. Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
【答案】A
【解析】
试题依据还原剂的还原性>还原产物的还原性,反应2FeCl3+2HI==2FeCl2+2HCl+I2 中还原性I-> Fe2+,反应H2SO3+I2+H2O===2HI+H2SO4中还原性H2SO3> I-,反应3FeCl2+4HNO3==2FeCl3+NO↑+2H2O+Fe(NO3)3中还原性Fe2+> NO,综上分析可得还原性H2SO3> I-> Fe2+> NO,答案选A。
考点:考查氧化性、还原性强软的比较
【题型】单选题
【结束】
26
【题目】(1)下列物质:①.Cu ②.NaCl晶体 ③.NaHSO4 ④.CO2 ⑤.CaO ⑥HCl ⑦.稀H2SO4 ⑧. 熔融Ba(OH)2 ⑨.C2H5OH ⑩.NaCl溶液。
属于电解质的是(填序号,下同)_____,属于非电解质的是_____,能导电的是______。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 ___________________________;
②Al2(SO4)3 ________________________________;
③NH4NO3 ________________________。
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com