
研究性学习小组对某硫酸亚铁晶体(FeSO4?xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。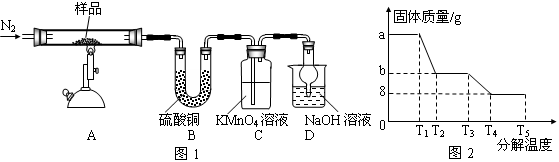
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x
=_________________________。
(1)SO2, (2)偏小
(4)2FeSO4 Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x=7
Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x=7
解析试题分析:(1)高锰酸钾具有强氧化性,能氧化一些还原性气体而褪色,所以根据装置C中高锰酸钾溶液褪色,说明产物中还有SO2气体生成。
(2)如果不充氮气水蒸气就不能全部从A中排出,因此导致x偏小。
(4)硫酸亚铁分解生成氧化铁、二氧化硫和三氧化硫,因此反应的化学方程式为2FeSO4 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。
(5)由于SO2、三氧化硫极易被氢氧化钠溶液吸收,所以装置D的作用是防止氢氧化钠溶液倒吸。
(6)根据图像可知,最终生成的氧化铁质量是8g。根据FeSO4?xH2O的化学式可知铁原子和水的个数比为1:x,则
Fe2O3~2XH2O
160g 36Xg
8g 12.6g
解得X=7
考点:考查硫酸亚铁晶体分解实验的有关判断、分析与计算


科目:高中化学 来源: 题型:填空题
氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
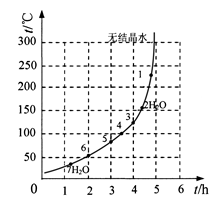
(6)下表和下图为“烘干粉碎”的试验结果。
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定某铝镁合金中镁的质量分数,某小组计划将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。填写下列空白。
(1)同学们选用甲装置进行实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因是________________。
(2)同学们经讨论认为甲装置有两个方面会引起较大误差,分别是__________和__________。
(3)于是他们设计了实验装置乙。乙中导管a的作用是__________。若实验前后滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为______mL。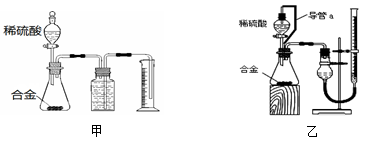
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学进行硫酸铜晶体结晶水含量的测定实验。完成下列填空:
【实验步骤】
(1)用_______(填仪器名称,下同)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入约2 g研细的硫酸铜晶体,并称量。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至____________中冷却到室温,并称量。
(4)重复(3)的实验进行恒重操作,直至两次称量结果相差不超过0.001 g。
【数据记录与处理】
| | 第一次实验 | 第二次实验 |
| 坩埚的质量(g) | 29.563 | 30.064 |
| 坩埚+试样的质量(g) | 31.676 | 32.051 |
| 恒重后,坩埚+硫酸铜的质量(g) | 30.911 | 31.324 |
| x的值 | 5.05 | 5.13 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时现象:__________________________________________________。
(2)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的体积 /mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
已知:几种化合物的溶解度(S)随温度(T)变化曲线如下图所示。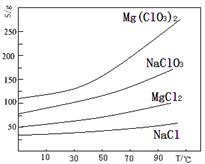
(1)过滤时主要玻璃仪器有 。加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是: 。
(3)“调节pH=4”可选用的试剂是 (填编号)
①MgO ②CuO ③稀NaOH溶液
④Mg ⑤稀硫酸 ⑥MgCO3
(4)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+。记录消耗K2Cr2O7溶液的体积。
①步骤2中发生反应的离子方程式为: 。
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则产品中Mg(ClO3)2·6H2O的含量会 。(填“偏高”、“偏低” 或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
[规格]每片含琥珀酸亚铁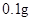 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 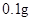 /日,成人治疗量 /日,成人治疗量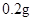 — —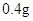 /日。 /日。小儿用量预防量 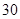 — —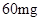 /日,治疗量 /日,治疗量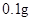 — —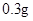 /日 /日[贮藏]避光、密封、在干燥处保存。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
白云石的主要成分为CaCO3、MgCO3,还含有少量Fe、Si的化合物,实验室以白云石为原料制Mg(OH)2及CaCO3。步骤如下:
实验过程中需要的数据见下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
| A.分液、萃取、蒸馏 | B.分液、蒸馏、萃取 |
| C.萃取、蒸馏、分液 | D.蒸馏、萃取、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com