
【题目】实验室探究SO2性质的装置如图所示。下列说法错误的是( )
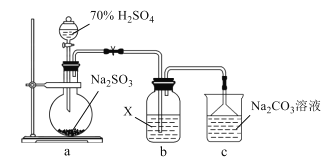
A.装置a中的反应可用铜片和浓硫酸代替
B.若X为H2S溶液,装置b中产生淡黄色沉淀
C.若X为含HCl、BaCl2的FeCl3溶液,装置b中产生白色沉淀
D.反应后装置c中溶液的pH降低
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
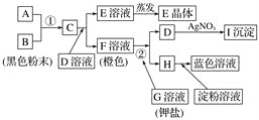
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.标准状况下,1.12L氦气所含的原子数为0.1NA
C.1.8 g NH4+离子中含有的电子数为NA
D.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
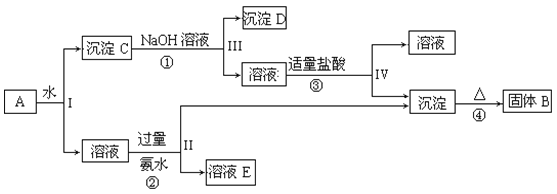
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式。
固体B___;C__;沉淀D___;
(3)写出①、②、③的离子方程式和④的化学方程式。
①___;
②___;
③___;
④____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸又称安息香酸(C6H5COOH),可用于合成纤维、树脂涂料等也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室中由甲苯制备苯甲酸的实验如下:
查阅资料:
①苯甲酸是一元有机弱酸不易被氧化。在水中溶解度:0.35g(25℃)、2.7g(80℃)、5.9g(100℃)。甲苯易溶于有机溶剂,不溶于水。
②
相对分子质量 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) | |
苯甲酸 | 122 | 122.4 | 249 | 1.3 |
甲苯 | 92 | -95 | 110.6 | 0.9 |
实验步骤:
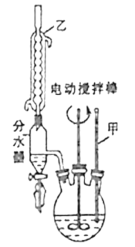
第一步:将9.2g甲苯和硫酸酸化的KMnO4溶液(过量)置于如图的三颈烧瓶中,加热保持反应物溶液温度在90℃左右至反应结束,主要反应为5C6H5CH3+6KMnO4+9H2SO4![]() 5C6H5COOH+3K2SO4+4MnSO4+14H2O,制备过程中不断从分水器分离出水;
5C6H5COOH+3K2SO4+4MnSO4+14H2O,制备过程中不断从分水器分离出水;
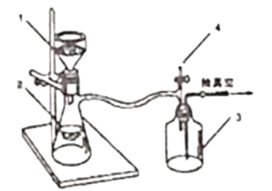
第二步:将反应后混合液趁热过滤滤液冷却后用硫酸酸化用如图装置抽滤得粗产品;(抽滤又称减压过滤利用抽气泵使抽滤瓶中的压强降低达到固液分离的目的。)
第三步:粗产品用水洗涤2到3次,干燥称量得固体![]() .
.
请回答下列问题:
(1)图1中装置乙的名称为___。
(2)分水器的作用是分离出水其主要目的是___,判断该反应进行完全的实验现象是___。
(3)实验第二步中,趁热过滤的原因是___,采用抽滤的优点是____。停止抽滤时先旋开图2中4处的旋塞恢复常压,然后关闭抽气泵,装置3起到的作用是____。
(4)第三步证明粗产品洗涤干净的方法是___。
(5)苯甲酸的产率为____。
(6)结合下列试剂和用品设计最简单实验验证苯甲酸是弱酸,具体操作为__。
0.010mol·L-1的苯甲酸溶液;0.010mol·L-1的苯甲酸钠溶液;0.010mol·L-1的氢氧化钠溶液;0.010mol·L-1的盐酸溶液;广泛pH试纸;甲基橙,酚酞(仪器任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下,下列说法正确的是
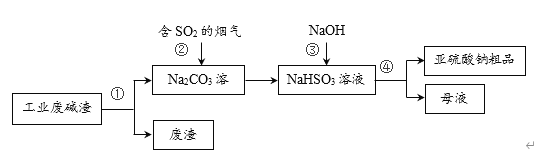
A.操作①、④均为过滤
B.步骤②中发生了置换反应
C.步骤③发生的反应为:NaHSO3+NaOH = Na2SO3+H2O
D.亚硫酸钠粗品中不可能含有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是无色透明有果香气味的液体。实验室制备乙酸正丁酯的反应方程式如下:CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
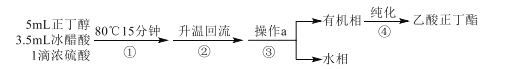
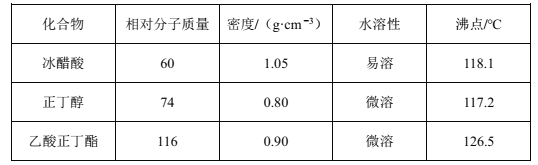
已知:乙酸正丁酯、正丁醇和水组成的三元共沸物的沸点为90.7℃。
反应装置如图所示。在烧瓶中加入反应物和沸石,分水器中加入一定体积水,80℃反应15分钟,然后提高温度使反应处于回流状态,分水器中液面不断上升,当液面达到分水器支管口时,上层液体返回到烧瓶中。

回答下列问题:
(1)仪器甲的名称是___。步骤①在80℃反应时温度计水银球置于___(填“a”或“b”)处。
(2)使用分水器能提高酯的产率,原因是___(用平衡移动原理解释)。
(3)步骤②观察到___(填标号)现象时,酯化反应已基本完成。
A.当分水器中出现分层 B.分水器中有液体回流至烧瓶
C.分水器水层高度不再变化 D.仪器甲有液体滴落
(4)若反应前分水器中加水不足,会导致___,使产率偏低。
(5)步骤③操作a的名称是___。
(6)步骤④中,依次用10%Na2CO3溶液、水洗涤有机相,分出的产物加入少量无水MgSO4固体,蒸馏,得到乙酸正丁酯4.64g。加入10%Na2CO3溶液的目的是除去___。乙酸正丁酯的产率为___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。
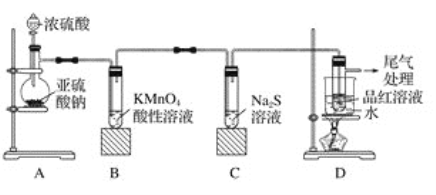
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是______________,该现象说明二氧化硫具有的性质是_____________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气吸收发生反应的离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com