
| A£® | H+£Øaq£©+OH-£Øaq£©=H2O£Øl£©”÷H=-a kJ/mol£¬¹Ź1 mol NaOH¹ĢĢåÓė×ćĮæµÄĻ”ŃĪĖį·“Ó¦£¬³öČČĮæĪŖa kJ | |
| B£® | ŅņCuSO4•5H2O£Øs£©=CuSO4£Øs£©+5H2O£Øl£©”÷H=+b kJ/mol£¬¹Ź1 mol CuSO4£Øs£©ČÜÓŚĖ®Ź±£¬·Å³öČČĮæb kJ | |
| C£® | ŅņĒāĘųµÄČ¼ÉÕČČĪŖc kJ/mol£¬¹Źµē½āĖ®µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2H2O£Øl£©=2H2£Øg£©+O2£Øg£©”÷H=+c kJ/mol | |
| D£® | ŅņN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-d kJ/mol£¬¹ŹŌŚÄ³ČŻĘ÷ÖŠĶ¶Čė1 mol N2Óė3 mol H2³ä·Ö·“Ó¦ŗ󣬷ųöČČĮæŠ”ÓŚd kJ |
·ÖĪö A£®ĒāŃõ»ÆÄĘ¹ĢĢåČÜÓŚĖ®·Å³öČČĮ棬Ōņ1molNaOH¹ĢĢåÓė×ćĮæµÄĻ”ŃĪĖį·“Ó¦·Å³öµÄČČĮæ“óÓŚa kJ£»
B£®øł¾ŻøĆ·“Ó¦Ö»ÄÜÖŖµĄ1molCuSO4£Øs£©Óė5molH2O£Ø1£©·“Ӧɜ³ÉmolCuSO4•5H2O£Øs£©·Å³öbkJČČĮ棻
C£®ĒāĘųµÄČ¼ÉÕČČĪŖ1molĒāĘųČ¼ÉÕÉś³É1molŅŗĢ¬Ė®·Å³öµÄČČĮ棬ŌņÉś³É2molĖ®·Å³öµÄČČĮæĪŖ2c£»
D£®øĆ·“Ó¦ĪŖæÉÄę·“Ó¦£¬1molN2Óė3 molH2³ä·Ö·“Ó¦ŗóÉś³É°±ĘųµÄĪļÖŹµÄĮæŠ”ÓŚ2mol£¬Ōņ·Å³öČČĮæŠ”ÓŚdkJ£®
½ā“š ½ā£ŗA£®ÓÉÓŚNaOH¹ĢĢåČÜÓŚĖ®»į·Å³öČČĮ棬Ōņ1molNaOH¹ĢĢåÓė×ćĮæµÄĻ”ŃĪĖį·“Ó¦·Å³öµÄČČĮæ“óÓŚa kJ£¬¹ŹA“ķĪó£»
B£®øł¾ŻCuSO4•5H2O£Øs£©=CuSO4£Øs£©+5H2O£Ø1£©”÷H=+b kJ/molæÉÖŖ£¬1molCuSO4£Øs£©Óė5molH2O£Ø1£©·“Ӧɜ³ÉmolCuSO4•5H2O£Øs£©·Å³öbkJČČĮ棬ĪŽ·Ø¼ĘĖć1molCuSO4£Ø s£©ČÜÓŚ×ćĮæĖ®Ź±·Å³öµÄČČĮ棬¹ŹB“ķĪó£»
C£®ĒāĘųµÄČ¼ÉÕČČĪŖckJ/mol£¬Ōņ·Ö½ā2molĖ®ŠčŅŖĪüČČ2ckJČČĮæ£¬ÕżČ·µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2H2O£Ø1£©=2H2£Ø g£©+O2£Ø g£©”÷H=+2ckJ/mol£¬¹ŹC“ķĪó£»
D£®N2£Ø g£©+3H2£Ø g£©?2NH3£Ø g£©”÷H=-d kJ/mol±ķŹ¾Éś³É2mol°±Ęų·Å³ödkJČČĮ棬ÓÉÓŚøĆ·“Ó¦ĪŖæÉÄę·“Ó¦£¬1molN2Óė3 molH2³ä·Ö·“Ó¦ŗóÉś³É°±ĘųµÄĪļÖŹµÄĮæŠ”ÓŚ2mol£¬Ōņ·“Ó¦·Å³öČČĮæŠ”ÓŚdkJ£¬¹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éĮĖ·“Ó¦ČČÓėģŹ±äµÄÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·»Æѧ·“Ó¦ÓėÄÜĮæ±ä»ÆµÄ¹ŲĻµĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕ·“Ó¦ČČÓėģŹ±äµÄ¹ŲĻµ¼°Ó¦ÓĆ·½·Ø£¬ŹŌĢāÓŠĄūÓŚĢįøßѧɜµÄ·ÖĪöÄÜĮ¦¼°Įé»īÓ¦ÓĆÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Mg2+”¢Na+”¢SO42-”¢Cl- | B£® | K+”¢CO32-”¢Cl-”¢NO3- | ||
| C£® | Na+”¢K+”¢NO3-”¢SO42- | D£® | NH4+”¢Na+”¢SO42-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 14g N2 | B£® | 4g H2 | ||
| C£® | ±ź×¼×“æöĻĀ11.2L CO2 | D£® | 0.5mol O2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
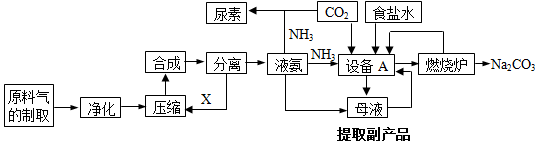
²éæ““š°øŗĶ½āĪö>>
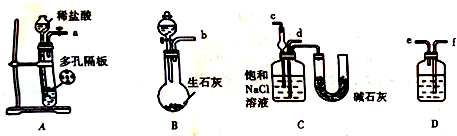
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
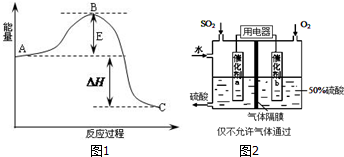
| Ń¹Ēæ/Mpa ×Ŗ»ÆĀŹ/% ĪĀ¶Č/”ę | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °ŃÉÕ±ÄŚµÄČÜŅŗ×ŖŅʵ½ČŻĮæĘæÖŠŹ±£¬±ŲŠėÓĆ²£Į§°ōŅżĮ÷ | |
| B£® | ÓĆ100mLĮæĶ²ĮæČ”95.20 mLŃĪĖį | |
| C£® | ÓĆĶŠÅĢĢģĘ½³ĘČ”25.20gNaCl | |
| D£® | ÓĆ500mLČŻĮæĘæÅäÖĘ50mL0.10mol/LČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Al3+£¬Na+£¬NO3-£¬Cl- | B£® | K+£¬Na+£¬Cl-£¬NO3- | ||
| C£® | K+£¬Na+£¬Cl-£¬AlO2- | D£® | K+£¬NH4+£¬SO42-£¬NO3- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com