
(每空1分,共6分)
A、B、C、D、E、F为六种短周期主族元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的0.75倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。
请回答下列问题:
(1)写出F元素原子结构示意图 ,元素B在周期表中的位置 。
(2)判断C、D、E原子半径的大小顺序 (填写元素符号,下同),比较B和E的气态氢化物的稳定性大小 。
(3)写出单质D与C的最高价氧化物的水化物反应的离子方程式 。
(4)由A、B、C、E四种元素共同构成的两种化合物在溶液中相互间可发生化学反应,试写出该反应的离子方程式 。
(1) ;第二周期、第ⅥA族;(2)Na>Al>S; H2O>H2S ;
;第二周期、第ⅥA族;(2)Na>Al>S; H2O>H2S ;
(3) 2Al+2OH-+2H2O=2AlO2-+3H2↑; (4) HSO3-+H+=H2O+SO2↑。
解析试题分析:根据题意可知:A是H元素;B是O元素;C是Na元素;D是Al元素;E是S元素;F 是Cl元素。(1)Cl元素原子结构示意图是 ;元素B在周期表中的位置是第二周期、第ⅥA族;(2)判断C、D、E三种元素是同一周期的元素,原子序数越大,原子半径就越小,所以原子半径的大小顺序是Na>Al>S; B和E是同一主族的元素,元素的原子核外电子层数越多,元素的氢化物的稳定性就越弱,所以B、E气态氢化物的稳定性大小关系是H2O>H2S ;(3)单质D与C的最高价氧化物的水化物反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑; (4)由A、B、C、E四种元素共同构成的两种化合物NaHSO4、NaHSO3在溶液中相互间可发生化学反应,该反应的离子方程式是HSO3-+H+=H2O+SO2↑。
;元素B在周期表中的位置是第二周期、第ⅥA族;(2)判断C、D、E三种元素是同一周期的元素,原子序数越大,原子半径就越小,所以原子半径的大小顺序是Na>Al>S; B和E是同一主族的元素,元素的原子核外电子层数越多,元素的氢化物的稳定性就越弱,所以B、E气态氢化物的稳定性大小关系是H2O>H2S ;(3)单质D与C的最高价氧化物的水化物反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑; (4)由A、B、C、E四种元素共同构成的两种化合物NaHSO4、NaHSO3在溶液中相互间可发生化学反应,该反应的离子方程式是HSO3-+H+=H2O+SO2↑。
考点:考查元素的推断、元素形成的化合物的性质的比较、原子结构、离子方程式的书写的知识。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:单选题
A、B分别为第三周期和第四周期的同一主族不同元素的原子,它们原子核内的质子数都等于中子数①若A为IIA族,其质量数为x,则B的质子数为y ②若A为ⅣA族,其质子数为m,则B的质量数为n,在下列各组值中,y和n的值分别是
A.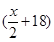 和
和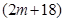
B.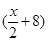 和
和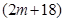
C.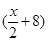 和
和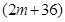
D.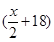 和
和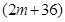
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是 ( )
| A.X能形成化学式为NaXO3的含氧酸钠盐 |
| B.X元素气态氢化物的水溶液呈酸性 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为 。
(2)Y原子中电子运动状态有 种, Z的气态氢化物在同主族元素气态氢化物中最高是因为 。
(3)Q在周期表中的位置 ,其基态原子简化电子排布式为 。交警可以用H2SO4酸化的K2 Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。
请写出此原理的离子方程式 。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式
。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(4)请写出下列物质的电子式。H2O CO2 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素;D的+1价阳离子与氖原子具有相同的电子层结构;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸。请根据以上信息回答下列问题。
(1)F元素在元素周期表中的位置是______________。
(2)B的氢化物的水溶液呈碱性,用离子方程式表示原因:______________。
(3)A2C2可以制备C2,该反应的化学方程式是______________。
(4)A、B、C 三种元素形成的既含离子键又含共价键的化合物的化学式是___________。
(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,所标的字母各代表一种化学元素。
试回答下列问题:
(1)元素M在第________周期第________族。
(2)C的10电子氢化物的电子________,D的简单氢化物的空间结构为________________。
(3)试写出一种由上述3种元素组成的不含有金属元素的离子化台物____________(填化学式)。
(4)上述元素中非金属性最强的元素是_____________(填元素符号),元素最高价氧化物对应水化物酸性最强的物质是_____________(填化学式)。
(5)写出G与I的最高价氧化物对应水化物反应的离子方程式:____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com