
【题目】同分异构现象是有机物种类繁多的重要原因之一,下列互为同分异构体的一组化合物是( )
A.甲烷和乙烷
B.乙醇和乙酸
C.正丁烷和异丁烷
D.氯乙烯和乙烯
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。反应化学方程式为:3C+2K2Cr2O7 +8H2SO4 = 3CO2↑+ 2K2SO4+2Cr2(SO4)3 +8 H2O
(1)上述反应中氧化剂是___________(填化学式), 被氧化的元素是_________(填元素符号)。
(2)H2SO4 在上述反应中表现出来的性质是____________(填选项编号)
A.氧化性 B.氧化性和酸性 C.还原性和酸性 D.酸性
(3)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______________L。
(4)请用双线桥法标出电子转移的方向和数目___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: 
(1)铁在元素周期表中的位置为 .
(2)配合物Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于(晶体类型).
(3)Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)=Fe(s)+xCO(g). 已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有、 .
(4)CN﹣中碳原子杂化轨道类型为 , 1mol CN﹣中含有π键的数目为 .
(5)铜晶体铜原子的堆积方式如图1所示.(面心立方最密堆积) ①基态铜原子的核外电子排布式为 .
②每个铜原子周围距离最近的铜原子数目 .
(6)某M原子的外围电子排布式为3s23p5 , 铜与M形成化合物的晶胞如图2所示(黑点代表铜原子,空心圆代表M原子). ①该晶体的化学式为 .
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于(填“离子”或“共价”)化合物.
③已知该晶体的密度为ρ gcm﹣3 , 阿伏伽德罗常数为NA , 则该晶体中铜原子与M原子之间的最短距离为cm(只写计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏伽德罗常数)( )
A.124 g P4含有P﹣P键的个数为4NA
B.60gSiO2中含Si﹣O键的个数为2NA
C.12 g石墨中含有C﹣C键的个数为1.5NA
D.36 g戊烷中共价键的个数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3KJ?mol﹣1 , 则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ?mol﹣1
B.500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g) ![]() ? 2NH3(g)△H=﹣38.6 KJ?mol﹣1
? 2NH3(g)△H=﹣38.6 KJ?mol﹣1
C.已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.6 KJ?mol﹣1
D.CO(g)的燃烧热是283.0 KJ?mol﹣1 , 则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是( )
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.滴定到终点读数时,发现滴定管尖嘴内有气泡
D.配制标准溶液的NaOH中混有KOH杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
B. 碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. 向Fe2(SO4)3溶液中加入过量铁粉:2Fe3++Fe===3Fe2+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
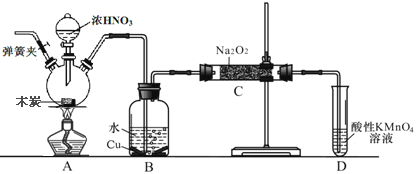
【题目】亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。已知:
① 3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
② 酸性条件下,NO与NO2-都能与MnO4-反应生成NO3-和Mn2+;
(1)盛浓硝酸仪器的名称是___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式__________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为_______L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭_______g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
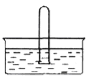
① NO2溶于水的化学方程式是______________________________________。
② 使试管中NO2完全被水吸收的操作是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com