
下列有关实验原理.方法和结论都正确的是( )
| A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡.静置后分液,可除去苯中少量苯酚 |
D.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
C
解析试题分析:A.氢氧化铁胶体的制备方法:向沸水中加入氯化铁溶液加热,至出现红褐色的胶状物,向饱和FeCl3溶液中滴加过量氨水,会出现红褐色沉淀,故A错误;B.氯气具有氧化性,可以将亚铁离子氧化,生成三价铁离子,三价铁离子可以和KSCN溶液发生显色反应,显红色,如果取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,溶液中就是只含有三价铁离子时也具有该现象,不能确定是否含有亚铁离子,故B错误;C.向苯和少量苯酚的混合溶液中加入适量NaOH溶液,其中苯酚可以和氢氧化钠反应生成苯酚钠水溶液,苯不易溶于水,震荡会分层,分液,上层的是苯,这样可除去苯中少量苯酚,故C正确;D.向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,是由于碘易溶于四氯化碳,而四氯化碳和水互不相溶,促进平衡向正反应方向移动,故D错误.故选C。
考点:离子检验和除杂问题是现在考试的热点,注意物质的性质的灵活应用,要求学生具有分析和解决问题的能力,难度不大。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:单选题
下列实验不能达到实验目的的是
| A.用结晶法提纯混有少量氯化钾的硝酸钾 |
| B.用KSCN检验溶液中Fe3+的存在 |
| C.用湿润的淀粉碘化钾试纸检验氯气 |
| D.用酒精萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用下列实验装置进行相应实验,能达到实验目的的是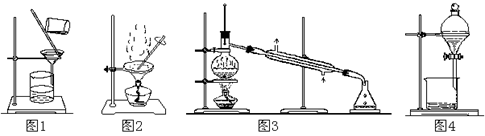
A B C D
| A.用图1 所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
| B.用图2 所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H2O晶体 |
| C.用图3 所示装置从CH3OH与C2H5OH的混合物中分离出乙醇 |
| D.用图4 所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用下列实验装置进行相应实验.能达到实验目的的是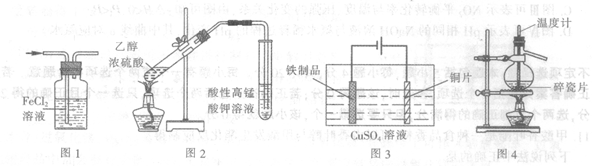
| A.用图1所示装置除去HCl气体中的少量C12 |
| B.用图2所示装置检验加热时产生的乙烯 |
| C.用图3所示装置在铁制品表面镀铜 |
| D.用图4所示装置分离溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验装置的说法中正确的是 ( )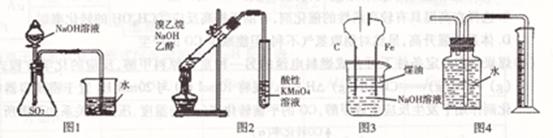
| A.用图1可证明SO2与NaOH溶液发生了反应 |
| B.用图2装置不能证明溴乙烷发生消去反应 |
| C.用图3装置制备Fe( OH)2并能较长时间观察其颜色 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验设计能够成功的是
A.检验亚硫酸钠试样是否变质:
试样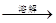 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解 说明试样已变质
说明试样已变质
B.除去粗盐中含有的硫酸钙杂质
粗盐

 精盐
精盐
检验某溶液中是否含有Fe2+
试样 溶液颜色无变化
溶液颜色无变化 溶液变红色
溶液变红色 溶液中含有Fe2+
溶液中含有Fe2+
D.明酸性条件H2O2的氧化性比I2强:
NaI溶液
 溶液变蓝色
溶液变蓝色 氧化性:H2O2>I2
氧化性:H2O2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: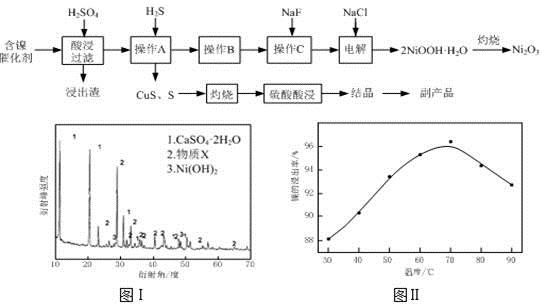
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com