

| ��ʼ������pH | ��ȫ������pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
���� ��ҵ��Co����ϡ����������ܣ��õ�����A����CoSO4��Fe��OH��3��Si����ҺB����Co2+��������������CoC2O4����ϴ�ӡ�������յõ������ܣ�
��1����������Ӧ��
��2����������ˮ�⣬����Co3��PO4��2�ɵ�����ҺpH��ʹ������ȫ��������
��3��Co�����ᷢ��������ԭ��Ӧ��
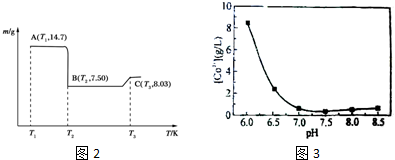
��4��AΪCoC2O4��n��CoC2O4��=$\frac{14.7g}{147g/mol}$=0.1mol��m��Co��=0.1mol��59g/mol=5.9g��C�������������Ϊ8.03g����n��O��=$\frac{8.03g-5.9g}{16g/mol}$=1.33���Դ˼��㣻
��5���ɱ������ݿ�֪��Ӧ�ȼ����������Ƴ�ȥFe3+��Al3+���ɵ���pH5.0��7.2֮�䣬Ȼ����ˣ�����Һ�м���һ��Ũ�ȵ�̼���Һ������pH��7.0���ң�ʹCo2+������ȫ�����ˣ�������ˮ������70�����ϣ�ϴ��CoCO3����3�Σ����������400�決��3h���ò�Ʒ�����ܣ�
��� �⣺��ҵ��Co����ϡ����������ܣ��õ�����A����CoSO4��Fe��OH��3��Si����ҺB����Co2+��������������CoC2O4����ϴ�ӡ�������յõ������ܣ�
��1����������Ӧ������A����CoSO4��Fe��OH��3��Si��
�ʴ�Ϊ��Si��
��2����������ˮ�⣬����Co3��PO4��2�ɵ�����ҺpH����֤Co2+����������ʹ������ȫ��������
�ʴ�Ϊ��������ҺpH����֤Co2+����������ʹ������ȫ��������
��3��Co�����ᷢ��������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ3Co+8H++2NO3-�T3Co2++4H2O+2NO����
�ʴ�Ϊ��3Co+8H++2NO3-�T3Co2++4H2O+2NO����
��4��AΪCoC2O4��n��CoC2O4��=$\frac{14.7g}{147g/mol}$=0.1mol��m��Co��=0.1mol��59g/mol=5.9g��C�������������Ϊ8.03g����n��O��=$\frac{8.03g-5.9g}{16g/mol}$=1.33����ѧʽΪCo3O4��
�ʴ�Ϊ��Co3O4��
��5���ɱ������ݿ�֪��Ӧ�ȼ����������Ƴ�ȥFe3+��Al3+���ɵ���pH5.0��7.2֮�䣬Ȼ����ˣ�����Һ�м���һ��Ũ�ȵ�̼���Һ������pH��7.0���ң�ʹCo2+������ȫ�����ˣ�������ˮ������70�����ϣ�ϴ��CoCO3����3�Σ����������400�決��3h���ò�Ʒ�����ܣ�
�ʴ�Ϊ����pH��5.0��7.2����Fe3+��Al3+���ۿ���pH��7.0���ң�ʹCo2+������ȫ�����ˣ�
���� ���⿼���������ᴿ�ͷ���Ĺ�ҵ�Ʊ����̷����жϣ�Ϊ�߿��������ͣ�������ѧ���ķ���������ʵ�������ͼ��������Ŀ��飬����ʵ����̵ķ���Ӧ�ã���Ҫ���������ʵ�����Ӧ�ã���Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
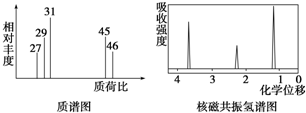
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Al��OH��3 | Fe��OH��2 | Fe��OH��3 | Mn��OH��2 | |
| ��ʼ����ʱ | 3.4 | 6.3 | 1.5 | 7.6 |
| ��ȫ����ʱ | 4.7 | 8.3 | 2.8 | 10.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
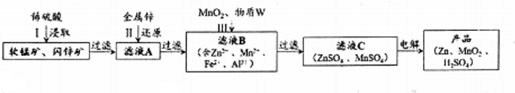
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | K+��Na+��Fe2+��Ba2+��NH${\;}_{4}^{+}$��Ca2+ |
| ������ | OH-��NO${\;}_{3}^{-}$��I-��HCO${\;}_{3}^{-}$��AlO${\;}_{2}^{-}$��HSO${\;}_{4}^{-}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
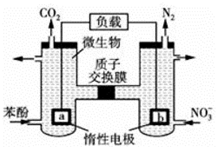
| A�� | a�缫��ӦʽΪC6H5OH-28e-+11H2O�T6CO2��+28H+ | |
| B�� | ��������Ϊa�����ء�b�����ӽ���Ĥ��a | |
| C�� | H+������ͨ�����ӽ���Ĥ�������� | |
| D�� | ����1mol����ת��ʱ����������2.24L���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com