
【题目】铝、氧化铝、氢氧化铝等在工业上用途广泛。
(1)用原子结构知识解释Al的金属性比Na弱:Al与Na在元素周期表中位于同一周期,_________________,Al的金属性比Na弱。
(2)结合化学用语,用化学平衡知识解释,氢氧化铝既溶于强酸溶液,又溶于强碱溶液:_______________________。
(3)Al2O3是制备二甲醚(CH3OCH3)的反应中的重要催化剂。
已知由H2、CO制备二甲醚过程为:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出由H2、CO制备二甲醚的总的热化学方程式____________。
工业上以铝土矿(主要成分是氧化铝,含氧化铁、氧化镁、二氧化硅、氧化铜等杂质)为原料提取铝、氧化铝、氢氧化铝的无机化工流程如图:
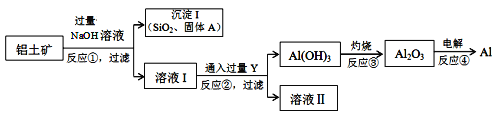
[已知:该条件下NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑]
(4)固体A为________________________________。
(5)写出反应②的离子方程式为___________________________。
(6)反应④所得的铝材中,往往含有少量的铁和硅等杂质,可用电解精炼法进一步提纯,该电解池中阳极的电极反应式为__________________,下列可作阴极材料的是 ______
A.铝材 B.石墨 C.纯铝 D.铅板
(7)铝土矿中Al2O3的含量为40.8%,要使1t铝土矿中的Al2O3全部溶解理论上至少需要NaOH的质量为________t。
【答案】核电荷数Al〉Na,原子半径Al〈Na,失电子能力Al〈Na Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液。 2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 Fe2O3、MgO、CuO AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3- Al-3e-=== Al3+ C 0.32 t
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液。 2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 Fe2O3、MgO、CuO AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3- Al-3e-=== Al3+ C 0.32 t
【解析】
(1)同一周期元素从左到右,原子半径逐渐减小,失电子能力逐渐减弱,金属性逐渐减弱;
(2) Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移;
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移;
(3) 根据盖斯定律,结合所给反应热化学方程式解答;
(4)~(7)由题给信息可以知道,铝土矿加入过量NaOH溶液可将铝与其它杂质分离,结合“NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑”可以知道,所得固体A含有SiO2、Fe2O3、MgO、CuO,滤液Ⅰ含有NaAlO2,通入过量Y生成氢氧化铝沉淀,则Y为CO2,滤液Ⅱ为NaHCO3溶液,灼烧氢氧化铝生成氧化铝,电解熔融的氧化铝可生成Al,以此解答。
(1)Al与Na在元素周期表中位于同一周期,核电荷数Al〉Na,原子半径Al〈Na,失电子能力Al〈Na,所以Al的金属性比Na弱;
因此,本题正确答案是:核电荷数Al〉Na,原子半径Al〈Na,失电子能力Al〈Na;
(2)Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
因此,本题正确答案是:Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
(3)根据盖斯定律:第一个反应式×2+第二个反应得出:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△H=(-90.1×2-24.5)kJ·mol-1=-204.7kJ·mol-1。
因此,本题正确答案是:2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 ;
(4)由分析可以知道固体A为Fe2O3、MgO、CuO,
因此,本题正确答案是:Fe2O3、Mg、CuO;
(5)反应②为偏铝酸钠与过量二氧化碳的反应,生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3-,
因此,本题正确答案是:AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3-;
(6)在电解池中阳极发生氧化反应,金属失去电子,电极反应式为Al-3e-=== Al3+,电解精炼铝应以纯铝作阴极材料,故选C,
因此,本题正确答案是:Al-3e-=== Al3+;C;
(7)铝土矿中Al2O3的含量为40.8%,1t铝土矿中的Al2O3的物质的量为![]() =4000mol,与氢氧化钠溶液发生Al2O3+2NaOH=2NaAlO2+H2O,由方程式可以知道需要8000molNaOH,质量为
=4000mol,与氢氧化钠溶液发生Al2O3+2NaOH=2NaAlO2+H2O,由方程式可以知道需要8000molNaOH,质量为![]() =0.32t,
=0.32t,
因此,本题正确答案是:0.32t。


科目:高中化学 来源: 题型:
【题目】某烃A不能使酸性KMnO4溶液褪色,含碳量为92.3%,0.1mol A完全燃烧时生成13.44L二氧化碳(标准状况)。
(1)A的结构简式为_________。
(2)根据下列条件写出有关反应的化学方程式并指明反应类型:
①A与浓硫酸和浓硝酸的混合液反应生成B:__________,___________反应。
②在催化剂作用下A与H2反应生成C:_______________,__________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
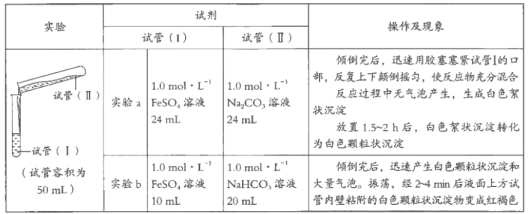
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:_________________________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入__________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改为15mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是___________________________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:_____________________________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变为红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:_________________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
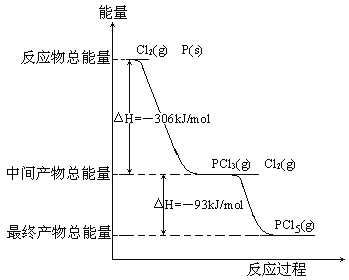
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是
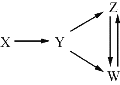
选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂能将工厂排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入Na2CO3溶液,其原理如图所示。
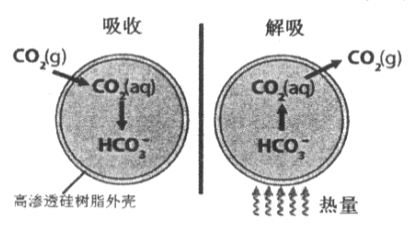
(1)这种微胶囊吸收CO2的原理是________(用离子方程式解释),此过程是____(填“吸收”或“放出”)能量的过程。
(2)在吸收过程中关于胶囊内溶液下列说法正确的是_____________。
a. 吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b. 吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c. 当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d. 溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
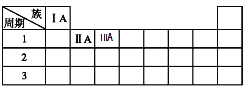
(3)下表为元素周期表的一部分,请将Na、C元素填在表中对应的位置上______________。
(4)生活中,经常用热的碳酸钠溶液清洗油污,结合化学用语,用必要的文字说明原因______________________。
(5)太阳能热电化学(STEP)生产水泥法可使二氧化碳排放量完全为零。基本原理如下图所示。利用熔融的碳酸钠为电解质,碳酸钙先分解成为CaO和CO2。最后得到石灰(CaO)、碳和氧气。
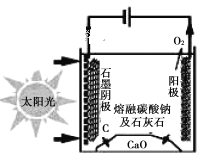
石墨电极上的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氨气通常有两种方法:
①用固体氢氧化钙与氯化铵共热;
②在常温下用固体氢氧化钠与浓氨水反应。
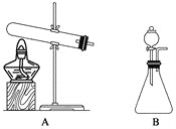
(1)上面的制取装置图中,方法①应选用装置__________(填“A”或“B”,下同);方法②应选用装置__________。
(2)加热氯化铵与氢氧化钙混合物制取氨气的反应方程式是________________。
(3)在制取后,如果要干燥氨气,应选用的干燥剂是________________(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷
(4)检验集气瓶中是否收集满氨气的方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2xH2O的化学方程式为______________________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__________(填字母代号)。
(3)滴定终点的判定现象是________________________________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样wg,消耗c mol/LNH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com