
«Ž‘ň”√ĽĮ—ß∑ī”¶‘≠ņŪĶńŌŗĻō÷™ ∂—–ĺŅŐľľį∆šĽĮļŌőÔĶń–‘÷ °£
£®1£©Ļ§“Ķ…Ō“Ľį„“‘COļÕH2ő™‘≠ŃŌļŌ≥…ľ◊īľ£¨‘ŕļ„»›»›∆ų÷–£¨ł√∑ī”¶Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺő™£ļ
CO(g)£ę2H2(g)  CH3OH(g)°°°ųH1£Ĺ£≠116 kJ°§mol£≠1
CH3OH(g)°°°ųH1£Ĺ£≠116 kJ°§mol£≠1
ĘŔŌ¬Ń–īŽ ©÷–ń‹ňĶ√ų∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨Ķń «___________
| A£ģŐŚŌĶ—Ļ«ŅĪ£≥÷≤ĽĪš |
| B£ģĽžļŌ∆ÝŐŚĶń√‹∂»Ī£≥÷≤ĽĪš |
| C£ģCO”ŽH2ĶńŇ®∂»÷ģĪ»ő™1°√2 |
| D£ģĶ•őĽ Īľšńŕ£¨ŌŻļń2molH2ĶńÕ¨ ĪŌŻļń1mol CH3OH |
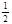 O2(g)=CO2(g) °ųH2£Ĺ£≠283 kJ°§mol-1 H2(g)+
O2(g)=CO2(g) °ųH2£Ĺ£≠283 kJ°§mol-1 H2(g)+ 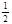 O2(g)=H2O(g) °ųH3£Ĺ£≠242 kJ°§mol-1
O2(g)=H2O(g) °ųH3£Ĺ£≠242 kJ°§mol-1£®1£©ĘŔAD£®2∑÷£¨¬©—°Ķ√1∑÷£¨īŪ—°Ķ√0∑÷£©
Ęŕ270°ś£®2∑÷£¨őřĶ•őĽĽÚĶ•őĽīŪŅŘ1∑÷£©£¨
£®2£©CH3OH(g)£ę3/2O2(g) CO2(g)£ę2H2O(g) °ųH£Ĺ£≠651kJ°§mol£≠1 £®2∑÷£©
CO2(g)£ę2H2O(g) °ųH£Ĺ£≠651kJ°§mol£≠1 £®2∑÷£©
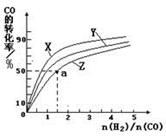
Ĺ‚őŲ ‘Ő‚∑÷őŲ£ļ£®1£©ĘŔA—°ŌÓ“Ú∑ī”¶«įļů∆ÝŐŚĶńŃŅ∑Ę…ķłńĪš£¨—Ļ«Ņ≤ĽĪš£¨Ņ…“‘ňĶ√ųĶĹīÔ∆Ĺļ‚°£D—°ŌÓ¬ķ◊„V’ż=VńśĘŕ“Úő™ZÕľŌŮ÷–COĶń◊™ĽĮ¬ ◊ÓĶÕ£¨ňý“‘∂‘”¶Ķńő¬∂»◊ÓłŖ°£270°ś °£łýĺ›ÕľŌŮŅ…÷™aĶ„∂‘”¶ĶńCOĶń◊™ĽĮ¬ ő™50%£¨H2ĶńőÔ÷ ĶńŃŅő™1.5 mol
CO£®g£© +°°°° 2H2(g)°° °° CH3OH(g)
°° CH3OH(g)
∆ū ľőÔ÷ ĶńŃŅŇ®∂»(mol/L)°° 1°°°°°°°°°°°°°°1.5°°°°°°°°°°°° 0°°°°°°°°
◊™ĽĮőÔ÷ ĶńŃŅŇ®∂»(mol/L)°°0.5°°°°°°°°°°°°°°1°°°°°°°°°°°° 0.5
∆Ĺļ‚őÔ÷ ĶńŃŅŇ®∂»(mol/L)°°0.5°°°°°°°°°°°°°°0.5°°°°°°°°°°°°0.5°°°°°°
K=4
£®2£©ņŻ”√ł«ňĻ∂®¬…Ņ…“‘–ī≥ŲCH3OH(g)£ę3/2O2(g) CO2(g)£ę2H2O(g) °ųH=°™°ųH1+°ųH2+2°ųH3
CO2(g)£ę2H2O(g) °ųH=°™°ųH1+°ųH2+2°ųH3
ŅľĶ„£ļĽĮ—ß∆Ĺļ‚ĶńŇ–∂ŌļÕĽĮ—ß∆Ĺļ‚Ķńľ∆ň„°£



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
√ļĽĮĻ§÷–≥£–Ť—–ĺŅ≤ĽÕ¨ő¬∂»Ō¬∆Ĺļ‚≥£ ż°ĘÕ∂ŃŌĪ»ľį»»÷ĶĶ»ő Ő‚°£
“—÷™£ļCO£®g£©+H2O£®g£©  H2£®g£©+CO2£®g£©∆Ĺļ‚≥£ żňśő¬∂»ĶńĪšĽĮ»ÁŌ¬ĪŪ£ļ
H2£®g£©+CO2£®g£©∆Ĺļ‚≥£ żňśő¬∂»ĶńĪšĽĮ»ÁŌ¬ĪŪ£ļ
| ő¬∂»/°ś | 400 | 500 | 800 |
| ∆Ĺļ‚≥£ żK | 9.94 | 9 | 1 |
| | n£®CO£© | n£®H2O£© | n£®H2£© | n£®CO2£© |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
 2CO£®g£©∆Ĺļ‚≥£ żK£ĽKĶńĪŪīÔ Ĺ £Ľ
2CO£®g£©∆Ĺļ‚≥£ żK£ĽKĶńĪŪīÔ Ĺ £Ľ CO£®g£©+H2£®g£© ∆Ĺļ‚≥£ żK1£Ľ
CO£®g£©+H2£®g£© ∆Ĺļ‚≥£ żK1£Ľ H2£®g£©+CO2£®g£©∆Ĺļ‚≥£ żK2£Ľ
H2£®g£©+CO2£®g£©∆Ĺļ‚≥£ żK2£Ľ 2CO£®g£©ń‹Ň–∂Ōł√∑ī”¶īÔĶĹĽĮ—ß∆Ĺļ‚◊īŐ¨Ķń“ņĺ› «________°£
2CO£®g£©ń‹Ň–∂Ōł√∑ī”¶īÔĶĹĽĮ—ß∆Ĺļ‚◊īŐ¨Ķń“ņĺ› «________°£ 2CO£®g£©£¨≤Ęő¨≥÷∑ī”¶Ļż≥Ő÷–ő¬∂»≤ĽĪš°£“—÷™ľ◊»›∆ų÷–
2CO£®g£©£¨≤Ęő¨≥÷∑ī”¶Ļż≥Ő÷–ő¬∂»≤ĽĪš°£“—÷™ľ◊»›∆ų÷–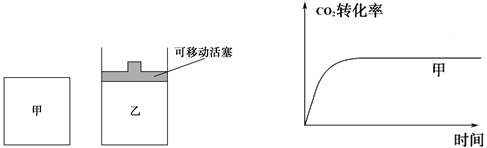
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
»ÁÕľňý ĺ£¨ľ◊°Ę““÷ģľšĶńłŰįŚKļÕĽÓ»ŻF∂ľŅ…◊ů”““∆∂Į£¨ľ◊÷–≥š»Ž2 mol SO2ļÕ1 mol O2£¨““÷–≥š»Ž2 mol SO3ļÕ1 mol He£¨īň ĪKÕ£‘ŕ0ī¶°£‘ŕ“Ľ∂®ŐűľĢŌ¬∑Ę…ķŅ…ńś∑ī”¶£ļ2SO2(g)£ęO2(g) 2SO3(g)£¨∑ī”¶īÔĶĹ∆Ĺļ‚ļů£¨‘ŔĽ÷łī÷Ń‘≠ő¬∂»£¨ĽōīūŌ¬Ń–ő Ő‚£ļ
2SO3(g)£¨∑ī”¶īÔĶĹ∆Ĺļ‚ļů£¨‘ŔĽ÷łī÷Ń‘≠ő¬∂»£¨ĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©»ŰĻŐ∂®łŰįŚK£¨ń‹ĪŪ ĺľ◊»›∆ų÷–“Ľ∂®īÔĶĹĽĮ—ß∆Ĺļ‚Ķń «
| A£ģľ◊÷–∆ÝŐŚĶń◊‹—Ļ«Ņ≤ĽĪš | B£ģłų∆ÝŐŚĶńőÔ÷ ĶńŃŅŇ®∂»≤ĽĪš |
| C£ģĽžļŌ∆ÝŐŚĶń∆Ĺĺýń¶∂Ż÷ ŃŅ≤ĽĪš | D£ģĽžļŌ∆ÝŐŚĶń√‹∂»≤ĽĪš |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
‘ŕ“Ľ∂®ŐŚĽżĶń√‹Ī’»›∆ų÷–£¨ĹÝ––»ÁŌ¬ĽĮ—ß∑ī”¶£ļ
Fe2O3(s)£ę3CO(g)  2Fe(s)£ę3CO2(g)£¨∆šĽĮ—ß∆Ĺļ‚≥£ żKļÕő¬∂»tĶńĻōŌĶ»ÁŌ¬ĪŪ£ļ
2Fe(s)£ę3CO2(g)£¨∆šĽĮ—ß∆Ĺļ‚≥£ żKļÕő¬∂»tĶńĻōŌĶ»ÁŌ¬ĪŪ£ļ
| t°ś | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
ő™ľű…ŔőŘ»ĺ£¨≥£Ĺę√ļ◊™ĽĮő™«ŚĹŗ∆ÝŐŚ»ľŃŌ£¨Ņ…ĹęĹĻŐŅ”Žňģ’Ű∆Ý∑ī”¶◊™ĽĮő™«‚∆ÝļÕ“Ľ—űĽĮŐľ£ļC(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g) 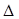 H>0°£Ō÷‘ŕ»›ĽżĻŐ∂®ő™2L√‹Ī’»›∆ų÷–£¨ľ”»Ž2mol C(s)ļÕ2mol H2O(g)£¨‘ŕT°śŌ¬≥š∑÷∑ī”¶£¨įŽ∑÷÷”ļůīÔĶĹ∆Ĺļ‚£¨≤‚Ķ√H2ő™0.75mol°£
H>0°£Ō÷‘ŕ»›ĽżĻŐ∂®ő™2L√‹Ī’»›∆ų÷–£¨ľ”»Ž2mol C(s)ļÕ2mol H2O(g)£¨‘ŕT°śŌ¬≥š∑÷∑ī”¶£¨įŽ∑÷÷”ļůīÔĶĹ∆Ĺļ‚£¨≤‚Ķ√H2ő™0.75mol°£
£®1£©”√H2O(g)ĪŪ ĺ∑ī”¶Ņ™ ľĶĹīÔĶĹ∆Ĺļ‚Ķń∆ĹĺýňŔ¬ £Ľ
£®2£©ľ∆ň„T°śŌ¬ł√∑ī”¶Ķń∆Ĺļ‚≥£ żK= £Ľ»Űő¬∂»…żłŖ£¨‘Ú∑ī”¶∆Ĺļ‚≥£ żĹę £®ŐÓ°į‘Ųīů°Ī°įľű–°°ĪĽÚ°į≤ĽĪš°Ī£©°£
£®3£©…Ō ŲŐűľĢŌ¬ł√∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «
| A£ģňű–°»›∆ųŐŚĽż£¨∆Ĺļ‚ŌÚ◊ů“∆∂Į | B£ģľ”»ŽīŖĽĮľŃ£¨COĶń≤ķ¬ ‘Ųīů |
| C£ģ‘Ųľ”ŐľĶńŃŅ£¨H2O(g)Ķń◊™ĽĮ¬ ‘Ųīů | D£ģĹĶĶÕő¬∂»£¨H2O(g)Ķń◊™ĽĮ¬ ĹĶĶÕ |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
Ļ§“Ķ…Ō“Ľį„“‘COļÕH2ő™‘≠ŃŌļŌ≥…ľ◊īľ£¨ł√∑ī”¶Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺő™£ļ
CO ( g ) + 2H2 ( g )  CH3OH ( g ) °ųH=-116kJ/mol
CH3OH ( g ) °ųH=-116kJ/mol
£®1£©ł√∑ī”¶ĶńĽĮ—ß∆Ĺļ‚≥£ żĪŪīÔ Ĺő™ £Ľ
£®2£©Ō¬Ń–īŽ ©÷–”–ņŻ”ŕ‘Ųīůł√∑ī”¶Ķń∑ī”¶ňŔ¬ «“ŐŠłŖ◊™ĽĮ¬ Ķń « (ŐÓ◊÷ńł–ÚļŇ) °£
a£ģňś ĪĹęCH3OH”Ž∑ī”¶ĽžļŌőÔ∑÷ņŽ b£ģĹĶĶÕ∑ī”¶ő¬∂»
c£ģ Ļ”√łŖ–ßīŖĽĮľŃ d£ģ‘ŲīůŐŚŌĶ—Ļ«Ņ
(3)“Ľ∂®ŐűľĢŌ¬£¨Ĺę1 mol CO”Ž3 mol H2ĶńĽžļŌ∆ÝŐŚ‘ŕīŖĽĮľŃ◊ų”√Ō¬∑Ę…ķ∑ī”¶…ķ≥…ľ◊īľ£¨∆Ĺļ‚ļůĹę»›∆ųĶń»›Ľż—ĻňűĶĹ‘≠ņīĶńl/2£¨∆šňŻŐűľĢ≤ĽĪš£¨∂‘∆Ĺļ‚ŐŚŌĶ≤ķ…ķĶń”įŌž « (ŐÓ◊÷ńł–ÚļŇ)£ģ
a£ģc ( H2 )ľű…Ŕ b£ģ’ż∑ī”¶ňŔ¬ ľ”Ņž£¨ńś∑ī”¶ňŔ¬ ľű¬ż
c£ģCH3OH ĶńőÔ÷ ĶńŃŅ‘Ųľ” d£ģ÷ō–¬∆Ĺļ‚c ( H2 )/ c (CH3OH )ľű–°
£®4£© ‘ŕ√‹Ī’»›∆ų÷–≥š”–1mol CO”Ž2 mol H2£¨‘ŕīŖĽĮľŃ◊ų”√Ō¬∑ī”¶…ķ≥…ľ◊īľ£¨COĶń◊™ĽĮ¬ (¶Ń)”Žő¬∂»(T)°Ę—Ļ«Ņ(P)ĶńĻōŌĶ»ÁÕľňý ĺ°£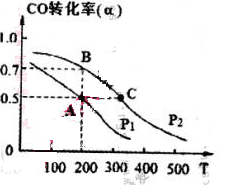
ĘŔA°ĘCŃĹĶ„∂ľĪŪ ĺīÔĶĹĶń∆Ĺļ‚◊īŐ¨£¨‘Ú◊‘∑ī”¶Ņ™ ľĶĹīÔ∆Ĺļ‚◊īŐ¨ňý–ŤĶń Īľš£¨tA tC(ŐÓ°įīů”ŕ°Ī°Ę°į–°”ŕ°Į°ĮĽÚ°įĶ»”ŕ")°£
Ęŕ»ŰAĶ„ Ī»›∆ųĶńŐŚĽżő™1 L£¨ł√ő¬∂»Ō¬BĶ„Ķń∆Ĺļ‚≥£ ż K= °£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
“Ľ∂®ŐűľĢŌ¬£¨∑ī”¶ “£®»›Ľżļ„∂®ő™2L£©÷–”–∑ī”¶£ļA(g) +2B(g) C(g)
C(g)
£®1£©ń‹ňĶ√ų…Ō Ų∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨Ķń « £®—°ŐÓ◊÷ńł£©°£
A£ģ∑ī”¶÷–A”ŽBĶńőÔ÷ ĶńŃŅŇ®∂»÷ģĪ»ő™1©U2
B£ģĽžļŌ∆ÝŐŚ◊‹őÔ÷ ĶńŃŅ≤Ľ‘ŔĪšĽĮ
C£ģĽžļŌ∆ÝŐŚĶń√‹∂»≤Ľňś ĪľšĶńĪšĽĮ∂ÝĪšĽĮ
D£ģ2¶‘’ż£®A£©= ¶‘ńś£®B£©
£®2£©ł√∑ī”¶∆Ĺļ‚≥£ żKĶńĪŪīÔ Ĺ£ļK= °£
£®3£©1molA(g)”Ž2molB(g)‘ŕīŖĽĮľŃ◊ų”√Ō¬‘ŕ∑ī”¶ “∑ī”¶…ķ≥…C(g)£¨AĶń∆Ĺļ‚◊™ĽĮ¬ ”Žő¬∂»°Ę—Ļ«ŅĶńĻōŌĶ»ÁŌ¬Õľňý ĺ£¨‘Ú£ļ
ĘŔP1 P2 £¨ ’ż∑ī”¶Ķń°ųH 0£®ŐÓ°į<°Ī°Ę°į>°ĪĽÚ°į=°Ī£©°£
ĘŕŌ¬Ń–īŽ ©÷–“Ľ∂®ń‹ Ļc(C)/c(A)‘ŲīůĶń « £®—°ŐÓĪŗļŇ£©°£
A£ģ…żłŖő¬∂» B£ģļ„ő¬ļ„»›‘Ŕ≥š»ŽA
C£ģļ„ő¬ļ„»›‘Ŕ≥š»ŽB D£ģļ„ő¬ļ„»›‘Ŕ≥š»Ž1 mol C
£®4£©100°ś ĪĹę1mol AļÕ2molBÕ®»Ž∑ī”¶ “£¨Ī£≥÷ő¬∂»≤ĽĪš£¨10minń©C(g) ĶńŇ®∂»ő™0.05mol/L £¨‘Ú10minń©B◊™ĽĮ¬ = £¨īň Ī¶‘’ż ¶‘ńś
£®ŐÓ°į<°Ī°Ę°į>°ĪĽÚ°į=°Ī£©°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
∂‘”ŕA(g)+B(g)  xC£®g£© ¶§H ”–:
xC£®g£© ¶§H ”–: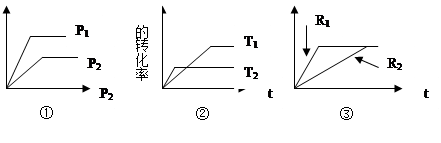
£®1£©ĘŔÕľĪŪ√ųP1 P2 ,«“xĶń÷Ķő™ £Ľ
£®2£©ĘŕÕľĪŪ√ųT1 T2 £¨«“¶§H 0£Ľ
£®3£©»ÁĻŻĘŘÕľR1,R2∑÷ĪūĪŪ ĺłńĪš—Ļ«Ņ£¨‘ÚR1 R2 ,xĶń÷Ķő™ £Ľ
£®4£©»ÁĻŻĘŘÕľ∑÷ĪūĪŪ ĺ”–őřīŖĽĮľŃ£¨‘ÚR1ĪŪ ĺ īŖĽĮľŃ°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļŐÓŅ’Ő‚
‘ŕ“Ľ∂®ŐŚĽżĶń√‹Ī’»›∆ų÷–£¨ĹÝ––»ÁŌ¬∑ī”¶£ļA£®g£© B£®g£©+C£®g£©£¨∆šĽĮ—ß∆Ĺļ‚≥£ żKļÕő¬∂»tĶńĻōŌĶ»ÁŌ¬ĪŪňý ĺ£ļ
| toC | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

| Īľšt/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 |
| C£®A£©/£®mol°§L£≠1£© | 10.4 | 8.6 | 7.5 | 6.6 | 5.9 | 5.5 | 5.5 |
≤ťŅīīūįłļÕĹ‚őŲ>>
įŔ∂»÷¬–Ň - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com