
①A+B![]() M+D+E;②M+E
M+D+E;②M+E![]() A+F+B。请针对以下两种不同情况来完成试题要求。
A+F+B。请针对以下两种不同情况来完成试题要求。
(1)若A是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为______________;反应②的离子方程式为____________________;在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为__________________________________________________________________。
(2)若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的阴离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层数的2倍,则X在元素周期表中的位置是______________。X单质的熔点是112.
(3)若A是(2)中的含氧酸盐,当以石墨作电极电解A溶液时,电流为aA,tmin后阴极增重wg,在阳极得到VL(标准状况)纯净气体,则阿伏加德罗常数NA的计算式是(1个电子的电荷量为qC):___________。
(1)![]()
Cl2+2OH-====Cl-+ClO-+H2O
2Fe2++ClO-+2H+====2 Fe3++Cl-+H2O
(2)第三周期第ⅥA族 分子
(3)![]()
提示:(1)由“日常生活中用作调味剂的盐”可判断A是氯化钠,电解饱和食盐水是化学工业上制取氯气(E)和氢氧化钠(M)的重要方法,说明A是氯化钠的判断正确。氯气与氢氧化钠溶液反应生成次氯酸钠(F)、氯化钠(A)和水(B),由于次氯酸钠是常见的强氧化剂,亚铁离子是常见的还原剂,根据“溶液从浅绿色变成黄色”判断氧化产物为铁离子,次氯酸根离子中的氯元素显+1价,得电子化合价降低,若降为0价生成的氯气可以氧化亚铁离子进一步降至-1价,因此次氯酸根离子的还原产物应为氯离子,根据得失电子守恒和电荷守恒就可以配平。
(2)实验室常用无水硫酸铜检验水的存在,1个硫酸根离子恰好含50个电子,其中的硫元素最外层电子数是6,电子层数是3,X为硫,位于元素周期表第三周期第ⅥA族。非金属单质硫的熔点较低可判断为分子晶体。
(3)由于阳极析出气体的体积未说明状态,不能选择气体体积进行计算。由阴极析出铜得到电子的电荷量计算,根据电极反应式Cu2++2e-====Cu和Q=It列式:(wg/![]()


科目:高中化学 来源: 题型:
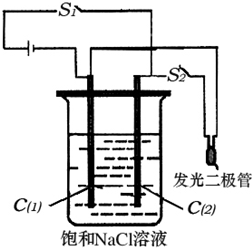 (1)现有如下两个反应:
(1)现有如下两个反应:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
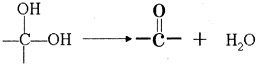
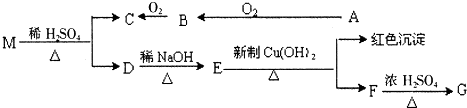
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省昆明三中、滇池中学高二下学期期末考试化学卷(带解析) 题型:填空题
(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)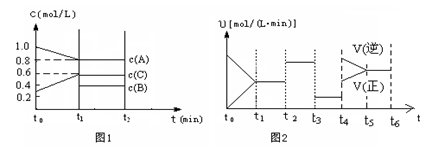
①你认为t3时改变的条件是 (填写“加压”或“减压”),B的起始物质的量为 mol;
②各阶段平衡时对应的平衡常数如下表所示:
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
 CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 (06年全国卷)萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等):
(06年全国卷)萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等):
(1)根据右图模型写出萨罗的结构简式_____
(2)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)。
(3)同时符合下列四个要求的水杨酸的同分异构体共有_______种。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH发生反应;
④只能生成两种一氯代物。
(4)从(3)确定的同分异构体中任意选一种,指定为下列框图中的A。

写出下列两个反应的化学方程式(有机物用结构简式表示),并指出相应的反应类型。
①A→B__________________________________。反应类型:_____________。
②B+D→E_______________________________。反应类型:_____________。
(5)现有水杨酸和苯酚的混合物,它们的物质的量之和为nmol。该混合物完全燃烧消耗aL O2,并生成bg H2O和cL CO2(气体体积均为标准状况下的体积)。
①分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物用结构简式表示)。
②设混合物中水杨酸的物质的量为xmol,列出x的计算式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com