
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,液氨中c(NH4+)与c(NH2-)的乘积为一常数 | |
| B. | 只要不加入其他物质,液氨中c(NH4+)总是与c(NH2-)相等 | |
| C. | 液氨的电离达到平衡时,c(NH3)=c(NH2-)=c(NH4+) | |
| D. | 液氨中含有NH3、NH4+和NH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环戊烯的化学性质跟链烯烃相似.
,环戊烯的化学性质跟链烯烃相似.
 )臭氧化分解各种产物的结构简式及其物质的量之比n(HCHO):n(CH3COCHO)=2:1.
)臭氧化分解各种产物的结构简式及其物质的量之比n(HCHO):n(CH3COCHO)=2:1.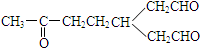 ,A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.则A的键线式为
,A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.则A的键线式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1 817 | 2 745 | 11 578 |
| Y | 738 | 1 451 | 7 733 | 10 540 |
| Z | 496 | 4 562 | 6 912 | 9 543 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅡA族中无非金属元素 | |
| B. | 零族的所有元素均满足最外层电子数为8 | |
| C. | 元素周期表中18个纵行对应18个族 | |
| D. | Ⅷ族中所含元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃,101kPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| D. | 25℃,101Kpa时,强酸与强碱的稀溶液发生反应的中和热为57.3kJ•mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式可表示为:H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(1)△H=-114.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水保存在棕色瓶中,冷暗处放置 | B. | 漂白粉可以敞口放置在空气中 | ||
| C. | 液氯可以保存在干燥的钢瓶中 | D. | Na在盛煤油的试剂瓶中密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种元素的相对原子质量为m+n | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若碳原子质量为Wg,此原子的质量为(m+n)Wg | |
| D. | 核内中子的总质量小于质子的总质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com