
| | 实验目的 | 操 作 |
| | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| | 欲证明溶液中含有SO42- | 滴入盐酸酸化的硝酸钡溶液 |
| | 欲证明溶液中含有S2- | 取少量溶液滴在醋酸铅试纸上看是否变黑 |
| | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| | 比较确定铜和镁的金属活动性强弱 | 用Pt作电极电解Mg(NO3)2、Cu( NO3)2混合液 |
| | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| B | 将Cl2通入NaBr溶液中 | 比较氯离子与溴离子的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
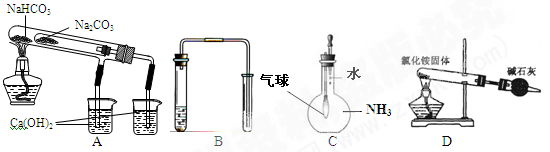
| A.验证NaHCO3和Na2CO3热稳定性大小 | B.用铜和稀硝酸制取并收集少量NO |
| C.验证明氨气的溶解性大小 | D.实验室用氯化铵制少量氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

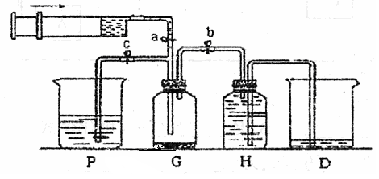
 。
。 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。| A.变大 | B.变小 | C.基本不变 | D.无法判断 |
 CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;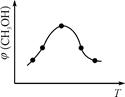
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
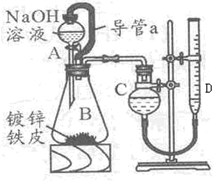
|

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠和冷水反应 Na+2H2O=Na++2OH?+H2↑ |
| B.金属铝溶于氢氧化钠溶液 Al+2OH?=AlO2?+H2 |
| C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ |
| D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 0.40 | 20.40 |
| 第2次 | 20.00 | 4.00 | 24.00 |
| 第3次 | 20.00 | 0.10 | 22.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
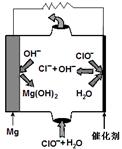
 2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。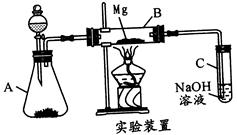
| 实验操作 | 预期现象 | 结论 |
| (1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 | 无白色沉淀产生 | 证明假设_______是正确的 |
| (2)若有白色沉淀产生再检测(1)的上层溶液的PH | 若PH>7 | 证明__________正确 |
| 若PH=7 若PH<7 | 证明__________正确 证明__________正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com