

 ��
�� ��
�� Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£����� ��������ͼ�У�A����ȡ����Ӧ����B��B������ԭ��Ӧ����C��C����ȡ����Ӧ����D��D����ȡ����Ӧ����E��E����ˮ�ⷴӦ����F��
��1���ݷ�ŵ��ҵĽṹ��ʽȷ�����������ƣ�
��2����A�Ľṹ��ʽȷ��A�ķ���ʽ��
��3�����ݷ�Ӧ���������仯ȷ����Ӧ���ͣ�
��4��������D��NaOH�Ĵ���Һ������ȥ��Ӧ��
��5����B�Ľṹ��ʽ�������Ϣȷ����ͬ���칹�壻
��6�� ��HBr����ȡ����Ӧ����
��HBr����ȡ����Ӧ����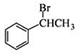 ��
�� ��NaCN��Ӧ����ˮ������
��NaCN��Ӧ����ˮ������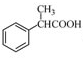 ��
��
��� �⣺��1���������еĹ��������Ѽ����Ȼ����ʴ�Ϊ���Ѽ����Ȼ���
��2���ݽṹ��ʽ��֪�������ʽΪC6H5Br���ʴ�Ϊ��C6H5Br��
��3��D����ȡ����Ӧ����E���ʴ�Ϊ��ȡ����Ӧ��
��4��DΪ ����NaOH�Ĵ���Һ�з�����ȥ��Ӧ����
����NaOH�Ĵ���Һ�з�����ȥ��Ӧ���� ����Ӧ����ʽΪ
����Ӧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��5��B����2��������2��Cԭ�ӡ�2��Oԭ�ӣ���ͬ���칹���ܷ���������Ӧ��˵������ȩ������ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ˵�����з��ǻ��γɵ������������к��������������ҷ�������6�ֲ�ͬ��ѧ���������ͬ���칹��Ϊ ��
��
�ʴ�Ϊ�� ��
��
��6�� ��HBr����ȡ����Ӧ����
��HBr����ȡ����Ӧ���� ��
�� ��NaCN��Ӧ����ˮ������
��NaCN��Ӧ����ˮ������ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�����л���ĺϳɣ���ȷ�л����к��еĹ����ż��������ǽⱾ��ؼ������������Ϣ���6���⣬ע�ⷴӦ�������л���ϼ��ͳɼ�λ�ã���Ŀ�Ѷ��еȣ�


 â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ0.158 mol•L-1•s-1 | |
| B�� | ��Ӧ��ʼ��10s��X�����ʵ���Ũ�ȼ�����0.79 mol•L-1 | |
| C�� | ��Ӧ��ʼ��10s��Y�����ʵ����ļ�����0.79mol | |
| D�� | ��Ӧ�Ļ�ѧ����ʽΪ��X��g��+Y��g��?Z��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
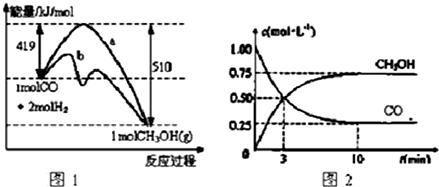
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ��ʯ���·ֽ� | B�� | ��������ķ�Ӧ | ||
| C�� | ������̼��̼��Ӧ | D�� | ���������������Ȼ�立�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��A��=0.5mol•L-1•s-1 | B�� | v��B��=0.3mol•L-1•s-1 | ||
| C�� | v��C��=0.8mol•L-1•s-1 | D�� | v�� D ��=1.0mol•L-1•s-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢ� | B�� | �٢� | C�� | �ڢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ
��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ ��
�� ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com