
【题目】将一定质量的镁铝合金投入100mL稀硝酸中完全溶解,反应过程中无气体放出。向反应后的溶液中,逐滴加入1.00 mol/L NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示,则下列说法错误的是( )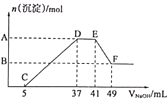
A.合金中镁铝的物质的量之比为1:2
B.合金完全溶解转移电子的物质的量为0. 032mol
C.原稀硝酸的物质的量浓度为0. 45 mol/L
D.F点溶液中,溶质仅为Na[Al(OH)4]
【答案】D
【解析】将一定质量的镁铝合金投入100mL稀硝酸中完全溶解,反应过程中无气体放出,说明硝酸生成的还原产物是铵根离子,所以镁铝合金与硝酸反应后所得的溶液中含有的阳离子有:Al3+、Mg2+、NH4+,若硝酸过量,则溶液中还可能还有H+,若含有H+,则向反应后的溶液中,逐滴加入NaOH溶液,各阳离子与OH-反应的先后顺序是:OH-先与H+反应生成水,再与Al3+、Mg2+反应生成沉淀,然后与NH4+反应生成一水合氨,最后与氢氧化铝沉淀反应,使氢氧化铝沉淀溶解。根据图像可知,开始滴入NaOH溶液时,无沉淀生成,故与镁铝合金反应时硝酸过量,反应后的溶液中含有H+。
A.根据上述分析可知,EF段发生的反应是:Al(OH)3+OH-=[Al(OH)4]-,此段消耗NaOH溶液的体积是(49-41)mL=8mL,则n(NaOH)=0.008L×1.00 mol/L=0.008mol,根据反应方程式,Al(OH)3的物质的量是0.008mol,则Al3+的物质的量也是0.008mol。CD段发生的反应是:Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,此段共消耗NaOH的物质的量是:(37-5)×10-3L×1.00 mol/L=0.032mol,因 Al3+的物质的量是0.008mol,则和Al3+反应消耗的NaOH为0.024mol,所以和Mg2+反应消耗的NaOH的物质的量是0.032mol-0.024mol=0.008mol,则Mg2+的物质的量是0.004mol,所以合金中镁铝的物质的量之比是:0.004mol:0.008mol=1:2,故A不符合题意
B.因合金中Mg的物质的量是0.004mol,反应中生成镁离子失去电子0.004mol×2=0.008mol,Al的物质的量是0.008mol,反应中生成铝离子失去电子0.008mol×3=0.024mol,所以反应中共转移电子0.008mol+0.024mol=0.032mol,故B不符合题意;
C.根据上述分析可知,在开始滴入NaOH溶液时,发生的反应是:H++OH-=H2O,此段消耗NaOH的物质的量是:0.005L×1.00 mol/L=0.005mol,根据反应方程式,则溶液中含有硝酸0.005mol,硝酸与Mg发生的反应是:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,Mg是0.004mol,则消耗硝酸0.01mol,硝酸与Al发生的反应是:8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O,Al是0.008mol,则消耗硝酸0.03mol,所以原硝酸溶液中HNO3的物质的量是:(0.005+0.01+0.03)=0.045mol,所以原硝酸溶液的物质的量浓度是0.045mol÷0.1L=0. 45 mol/L,故C不符合题意;
D.在F点,氢氧化铝完全溶解生成Na[Al(OH)4],但溶液中还含有NaNO3、NH3·H2O等溶质,故D符合题意;
所以答案是:D


科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能.
A.①②③④
B.⑤⑥⑦⑧
C.①③⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A.98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B.当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1 , 只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C.只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如图: 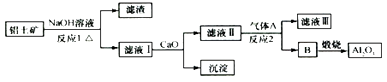
下列说法正确的是( )
A.气体A一定为HCl
B.滤液Ⅰ中溶质可能含NaAlO2
C.沉淀的主要成分不是硅酸钙
D.反应1、反应2均是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):
请回答下列问题:
(1)写出下列物质的结构简式:B , D;
(2)写出下列反应A→B的化学方程式 , 反应类型;
(3)写出下列反应C+E→F的化学方程式 , 反应类型 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1 mol OD﹣离子含有的质子、中子数均为10NA
B.标准状况下,4.48 L己烷含有的分子数为0.2NA
C.标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4是重要的化学试剂,其化学式还可以表示为FeO·Fe2O3 , 铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。

(1)图2中仪器a的名称是。
(2)根据题目要求,在图2中最好选择(填序号)作为A装置。
(3)对图2中装置②进行气密性检查的方法是。
(4)在B装置中发生的主要反应的化学方程式是。
(5)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有(填名称)。
(6)写出Fe3O4溶于足量稀硫酸的离子方程式 , 要检验所得溶液中的Fe3+ , 常用试剂是(填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com