
| A. | “氯碱法”的副产品为氢气 | B. | “铝热法”常用于冶炼铁 | ||
| C. | “空气吹出法”用于海水中提取碘 | D. | “侯氏制碱法”制得的是火碱 |
分析 A、氯碱工业是电解氯化钠溶液制备烧碱和氯气的工业;
B、铝热反应是金属铝和氧化铁之间的反应,产物是金属铁和氧化铝;
C、溴单质具有挥发性,碘单质易升华;
D、侯氏制碱法制取的是纯碱碳酸钠.
解答 解:A、氯碱工业是电解氯化钠溶液制备烧碱和氯气的工业,产物中还有氢气,所以“氯碱法”的副产品为氢气,故A正确;
B、铝热反应是金属铝和氧化铁之间的反应,产物是金属铁和氧化铝,金属铁的冶炼采用还原法,故B错误;
C、溴单质具有挥发性,碘单质易升华,“空气吹出法”用于海水中提取溴,故C错误;
D、侯氏制碱法制取的是纯碱碳酸钠,不是火碱氢氧化钠,故D错误,
故选A.
点评 本题涉及金属的冶炼、纯碱的制备、海水提溴原理等知识,注意基本知识的迁移应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
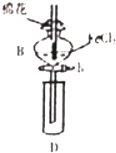 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 华裔科学家高琨因在光纤传输信息领域中取得突破性成就而获得诺贝尔奖,光纤的主要成分是高纯度的二氧化硅 | |
| C. | 玻璃钢是一种合金,广泛用于汽车车身 | |
| D. | 只要符合限量,“亚硝酸盐”、“食用色素”、“苯甲酸钠”可以作为某些食品的添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀质量相等 | B. | 现象相同,沉淀质量不相等 | ||
| C. | 现象不相同,沉淀质量相等 | D. | 现象不相同,沉淀质量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量的氯气通入碘化亚铁溶液:3Cl2+2Fe2++4I-═6Cl-+2Fe3++2I2 | |
| B. | 硫酸在加热条件下将铜氧化:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 在氢氧化钡溶液中加入过量的硫酸氢铵:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3↑+2H2O | |
| D. | 将金属钠投入水中:2Na+2H+═2Na++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| D. | O2的摩尔体积约为22.4L.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com