
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和Agl固体的悬浊液:c(Ag+)>c(Cl-)>(I-) | |
| C. | 25℃时,NH4Cl溶液的KN大于100℃时NaCl溶液的KN | |
| D. | 1g氢气燃烧生成液态水,放出的热量为142.9kJ.故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-285.8kJ•mol-1 |
分析 A、氨水是弱碱,加水稀释,促进电离;
B、碘化银的溶解度小于氯化银,根据Ksp=c(Ag+)•c(X-)来判断;
C、温度不同,不同物质的电离程度不同;
D、根据燃烧热是完全燃烧1mol物质生成最稳定的产物所放出的热量.
解答 解:A、pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,故A错误;
B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银,c(Ag+)>c(Cl-)>c(I-),故B正确;
C、温度不同,不同物质的电离程度不同,即25℃时,NH4Cl溶液的KN和100℃时NaCl溶液的KN之间大小无法比较,故C错误;
D、1g即0.5mol氢气燃烧生成液态水,放出的热量为142.9kJ,1mol氢气燃烧所放出的热量285.8kJ,即氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-285.8kJ•mol-1,故D正确.
故选BD.
点评 本题综合考查弱电解质的电离、沉淀溶解平衡以及燃烧热的含义知识,属于综合知识的考查,难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | KW/c(H+)=10-10 mol•L-1的溶液中:Na+、HCO3-、Cl-、K+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
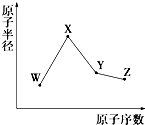 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料.Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料.Z的非金属性在同周期元素中最强.下列说法正确的是( )| A. | 对应简单离子半径:X>W | |
| B. | 对应气态氢化物的稳定性:Y>Z | |
| C. | 化合物XZW既含离子键,又含共价键,属于弱电解质 | |
| D. | Y的氧化物和Z的氢化物均能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成与氮的氧化物无关 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | 白酒中混有少量塑化剂,可通过过滤除去 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com