
����Ŀ��SO2�Ĵ������ǹ�ҵ��ȡ����Ĺؼ�����֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ��2SO2+O22SO3 �� ��H��0��
��ش��������⣺
��1���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��������ĸ����
a��SO2��SO3Ũ����� b��SO2�ٷֺ������ֲ���
c�������������ѹǿ���� d��SO3������������SO2�������������
��2�����÷�Ӧ����ƽ��״̬ʱ�����������������£����д�ʩ�����������SO2ƽ��ת���ʵ��� �� ������ĸ��
a����װ�����ٳ���N2 b����װ�����ٳ���O2
c���ı䷴Ӧ�Ĵ��� d�������¶�
��3����0.050mol SO2��g����0.030mol O2��g�������ݻ�Ϊ1L���ܱ������У���һ�������´ﵽƽ�⣬���c��SO3��=0.040mol/L������������·�Ӧ��ƽ�ⳣ��K��SO2��ת���ʣ�����д��������̣���
��ƽ�ⳣ��K=����ƽ��ʱ��SO2��ת���ʦ���SO2��=
��4��SO2β�����ñ���Na2SO3��Һ���գ�����SO2������Ⱦ���ɵõ���Ҫ�Ļ���ԭ��NaHSO3 �� ��֪NaHSO3
��Һͬʱ������������ƽ�⣺��HSO3��SO32��+H+ �� ��HSO3��+H2OH2SO3+OH���������£�0��l mol/L NaHSO3��Һ��pH��7�������Һ��c��H2SO3��c��SO32���������������=����������
���𰸡�
��1��bc
��2��bd
��3��1.6��103��80%
��4����
���������⣺��1��a��SO2��SO3Ũ����ȣ�������ô���淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����a���� b��SO2�ٷֺ������ֲ�����ƽ���־����b��ȷ��
c����Ӧǰ��������������仯�������������ѹǿ����˵����Ӧ�ﵽƽ��״̬����C��ȷ��
d��SO3������������SO2����������������㷴Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����d����
���Դ��ǣ�bc����2�����÷�Ӧ����ƽ��״̬ʱ�����������������£����SO2ƽ��ת���ʣ�ƽ��������У�
a����װ�����ٳ���N2 �� ���ݺ�����������ѹ�����ѹ���䣬ƽ�ⲻ�䣬��a����
b�����ַ�Ӧ������һ�ֻ������һ�ֵ�ת���ʣ���װ�����ٳ���O2 �� ����߶�������ת���ʣ���b��ȷ��
c���ı䷴Ӧ�Ĵ������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬��c����
d����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У���������ת��������d��ȷ��
���Դ��ǣ�bd�� ��3����0.050mol SO2��g����0.030mol O2��g�������ݻ�Ϊ1L���ܱ������У���һ�������´ﵽƽ�⣬���c��SO3��=0.040mol/L��
2SO2+ | O2 | 2SO3 | ||
��ʼ����mol�� | 0.05 | 0.03 | 0 | |
�仯����mol�� | 0.04 | 0.02 | 0.04 | |
ƽ������mol�� | 0.01 | 0.01 | 0.04 |
��ƽ�ⳣ��K= ![]() =1.6��103 �� ���Դ��ǣ�1.6��103��
=1.6��103 �� ���Դ��ǣ�1.6��103��
��ƽ��ʱ��SO2��ת���ʦ���SO2��= ![]() ��100%=80%�����Դ��ǣ�80%�� ��4����֪NaHSO3�е�HSO3�����ܵ�������ˮ�⣺HSO3��H++SO32�����������ԣ�HSO3��+H2OH2SO3 +OH�� ˮ���Լ��ԣ������£�0.1molL��1NaHSO3��Һ��pHС��7��
��100%=80%�����Դ��ǣ�80%�� ��4����֪NaHSO3�е�HSO3�����ܵ�������ˮ�⣺HSO3��H++SO32�����������ԣ�HSO3��+H2OH2SO3 +OH�� ˮ���Լ��ԣ������£�0.1molL��1NaHSO3��Һ��pHС��7��
˵���������ˮ�⣬�ʣ�c��SO32������c��H2SO3�������Դ��ǣ�����
�����㾫�������û�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���ж϶���Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 mLijŨ�ȵ�AlCl3��Һ�еμ�2 molL-1��NaOH��Һʱ,�õ�Al(OH)3����������(g)�����μ�NaOH��Һ�����(mL)��ϵ��ͼ��ʾ,�Իش���������:

��1��ͼ��A���ʾ�����Ļ�ѧʽ��_____�������ʵ�����_____��
��2����Ӧ��A��ʱ����NaOH��Һ�����Ϊ________��
��3��AlCl3��Һ��Ũ��Ϊ________��
��4��������Һ����0. 39��Al(OH)3����,���ʱ��ȥNaOH��Һ���Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��NaOH��Һ�ֳ����ȷݺֱ���pH=2��pH=3�Ĵ�����Һ��ȫ�кͣ������Ĵ�����Һ�����������Va L��Vb L����Va��Vb֮��Ĺ�ϵ�ǣ� ��
A.Va��10Vb
B.Vb=10Va
C.Vb��10Va
D.Vb��10Va
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǻ�ѧ��ҵ�г��õ����������л��ϳ��еĴ���������Ҫ�Ʊ�������̼�����ȷֽ⣬��Ӧԭ��Ϊ2MnCO3+O2�T2MnO2+2CO2 �� ���о����ָ÷�Ӧ����Ϊ��MnCO3�TMnO+CO2 ��2MnO+O2�T2MnO2 ��
�ش��������⣺
��1��ij�¶��¸�ƽ����ϵ��ѹǿΪP��CO2��O2�����ʵ����ֱ�Ϊn1��n2 �� ��ƽ���ѹ����ƽ��Ũ�ȣ�̼�����ȷֽⷴӦ��ƽ�ⳣ��K=����ѹ=��ѹ�����ʵ�����������K�뷴Ӧ�١��ڵ�ƽ�ⳣ��K1��K2�Ĺ�ϵΪ ��
��2����Ӧ���ڵ��������Է����У������H0�����������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ�������Ҫ�����ƽ�⣺CO2+H2OH2CO3 ![]() HCO3�� �� ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c��HCO3������c��H2CO3���仯��ϵ���±���
HCO3�� �� ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c��HCO3������c��H2CO3���仯��ϵ���±���
c��HCO | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
����˵������ȷ���ǣ� ��
A.��������ѪҺ�У�HCO ![]() ��ˮ��̶ȴ��ڵ���̶�
��ˮ��̶ȴ��ڵ���̶�
B.����ѪҺ���ж�ʱ����ע��NaHCO3��Һ����
C.pH=7.00��ѪҺ�У�c��H2CO3����c��HCO ![]() ��
��
D.pH=7.40��ѪҺ�У�HCO ![]() ��ˮ��̶�һ������H2CO3�ĵ���̶�
��ˮ��̶�һ������H2CO3�ĵ���̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬T��RΪ���ֳ�������;�ܹ�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ������W��Һ�м���KSCN����Ѫ��ɫ��
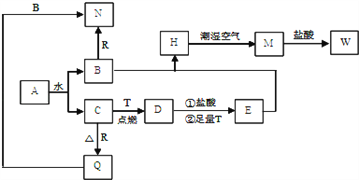
��1��д���������ʵĻ�ѧʽ��D______ N_______
��2��B��E��͵õ�H���ڳ�ʪ�����б��M�Ĺ����У����ܹ۲쵽������_______�� H�ڳ�ʪ�����б��M�Ĺ����з����Ļ�ѧ����ʽΪ��___________________��
��3����Ҫ��д����ʽ�� B��R��Ӧ����N�����ӷ���ʽ��______________________��M��W�����ӷ���ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ���Ũ�ȱ�����ȷ���ǣ� ��
A.0.3 mol?L��1��Na2SO4��Һ�к��е�Na+��SO ![]() �������ʵ���Ϊ0.9 mol
�������ʵ���Ϊ0.9 mol
B.��1 Lˮ����22.4 L����ʱ���ð�ˮ��Ũ�Ȳ���1 mol?L��1 �� ֻ�е�22.4 L��������ˮ�Ƶ�1 L��ˮʱ����Ũ�Ȳ���1 mol?L��1
C.��K2SO4��NaCl�����Ի��ˮ��Һ�У����Na+��SO42�������ʵ�����ȣ���K+��Cl�������ʵ���Ũ��һ����ͬ
D.10��ʱ��0.35 mol?L��1��KCl������Һ100 mL������5 gˮ����ȴ��10��ʱ�������С��100 mL���������ʵ���Ũ����Ϊ0.35 mol?L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧԴ����������������У����ǻ��������ָ����Ļ�ѧ��Ӧ��
��1��������Ƭ��ͭƬ�� FeCl2 ��Һ �� FeCl3 ��Һ�� CuSO4��Һ�� ���ʵ��֤�� Fe3+�������Ա� Cu2+ǿ�� д����Ӧ�Ļ�ѧ����ʽ______________��
��2��Ұ����ҵ�����ں������죬�÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��3����һ�������������� CO2���壬Ȼ��������ע�������� NaOH ��Һ�������ܷ�ڣ���һ��ʱ��ޱ��ڰ������ٹ�һ��ʱ��������¹��� �������ӷ���ʽ���������������¹����ԭ��______________��
��4����С�մ�Ƭ(NaHCO3)����θ��(����)��������ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6 molL��1��H2SO4��Һ�У���ͬѧ���缫����6 molL��1��NaOH��Һ�У���ͼ��ʾ��
��1��д�����������ĵ缫��Ӧʽ�� ��
��2�����и���Ϊ �� �ܷ�Ӧ�����ӷ���ʽΪ ��
��3�������ͬѧ����ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ������á�������жϳ�����Ԫ�ط��ţ��Ļ�Ը�ǿ�����һ��жϳ�����дԪ�ط��ţ��Ļ�Ը�ǿ��
��4���ɴ�ʵ��ó������н����У���ȷ����������ĸ����
A.����ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
B.þ�Ľ����Բ�һ�������Ľ�����ǿ
C.��ʵ��˵���������˳���ѹ�ʱ��û��ʵ�ü�ֵ��
D.��ʵ��˵����ѧ�о������ӡ���Ӧ������Ӱ��ϴ����Ӧ����������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com