
| A. | ①② | B. | ② | C. | ②③ | D. | ④ |
分析 在本题中,酸电离出的 C(H+)=0.1mol/L,碱液中 C(OH-)=1 mol/L,铝是足量的,所以生成氢气的量就取决于 n(H+)、n(OH-),而根据铝与酸碱的反应可知,当生成相同量的氢气时,需要的 n(H+) 比 n(OH-)多,所以当酸生成的氢气更多时,就需要 n(H+)>n(OH-),然后结合强酸完全电离,弱酸部分电离的特点来解本题.
解答 解:由铝与酸、碱的反应可知:
2Al~6H+~3H2 2Al~2OH-~3H2
要使生成的氢气前者多,必须n(H+)>n(OH-)
①当酸为多元强酸,由于C(H+)<C(OH-),当两种溶液体积相同时,则会有n(H+)<n(OH-),不符合题意,故①错误;
②若酸是一元弱酸,虽然酸电离出的 C(H+)小于氢氧化钠中的 C(OH-),但弱酸是部分电离,此时酸中的H+ 的总量完全可以比 NaOH 中的 OH- 多 故满足n(H+)>n(OH-),符合题意,故②正确;
③pH=1的酸中c(H+)=0.1mol/L,pH=14的NaOH溶液c(OH-)=1mol/L,若酸溶液的体积大于NaOH溶液30倍,定有n(H+)>3n(OH-),不管强酸和弱酸,故③正确,
④pH=1的酸中c(H+)=0.1mol/L,pH=14的NaOH溶液c(OH-)=1mol/L,若酸为强酸,则浓度不可能比NaOH溶液大,与题意矛盾,故④错误;
故选C.
点评 此题考查PH定义,强电解质和弱电解质的区别,铝单质的化学性质,其中强电解质和弱电解质的区别是难点,综合性较强,难度适中.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸易挥发,盛在无色密封的玻璃瓶中 | |
| B. | 氟化氢有剧毒,保存在有塑料盖的玻璃瓶中 | |
| C. | 液溴易挥发,盛放在用水封的棕色瓶中 | |
| D. | 碘易升华,保存在棕色瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑥ | C. | ②③⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团). .
. +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.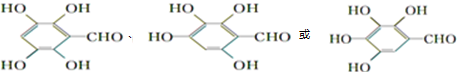 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴有能量变化 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物的总能量高于生成物的总能量时,发生吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com