
| A. | ①②③④⑤ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
分析 ①在醋酸溶液中存在的电离平衡:CH3COOH?CH3COO-+H+ 加水稀释后,溶液中氢离子浓度均减小,温度不变水的离子积不变,所以氢氧根离子浓度变大;
②从电离平衡移动的角度分析;
③醋酸钠是强碱弱酸盐水解呈碱性;
④正反应吸热,温度升高,平衡向正反应方向移动;
⑤X(g)+Y(g)?2Z(g)+W(s)△H>0,两边的气体的计量相等,容器压强始终不变;
⑥碳酸钙加入稀盐酸,氢离子与碳酸根离子反应生成二氧化碳;
⑦从难溶电解质的溶解平衡的角度分析
解答 解:①在醋酸溶液中存在的电离平衡:CH3COOH?CH3COO-+H+ 加水稀释后,溶液中氢离子浓度均减小,温度不变水的离子积不变,所以氢氧根离子浓度变大,故错误;
②醋酸电离产生醋酸根离子,加入醋酸钠,醋酸根离子浓度变大,则平衡向逆向移动,故正确;
③醋酸钠是强碱弱酸盐水解,CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+),所以溶液呈碱性,可使酚酞试液变红,故正确;
④正反应吸热,温度升高,平衡向正反应方向移动,c(Z)增大,故正确;
⑤X(g)+Y(g)?2Z(g)+W(s)△H>0,两边的气体的计量相等,容器压强始终不变,所以不能作平衡状态的标志,故错误;
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,氢离子与碳酸根离子反应生成二氧化碳,平衡向溶解的方向移动,故正确;
⑦碘化银的溶度积小于氯化银,则在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀,故正确.
故选B.
点评 本题考查较综合,题目涉及弱电解质的电离、盐的水解、化学平衡移动、沉淀溶解平衡移动等,题目难度中等,侧重对学生基础知识的巩固和训练,有助于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作(或设计) | 实验现象 | 结论 |
| A | 向溶液中滴加经盐酸酸化的BaCl2溶液 | 溶液中产生白色沉淀 | 溶液中含有SO42- |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡产生 | 镁作原电池的负极 |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升化 |
| D | 向KI溶液中滴入少量溴水和苯,振荡、静置 | 上层溶液呈紫红色 | I-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
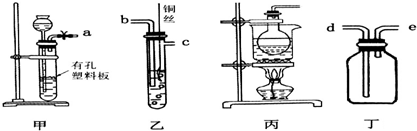
| A. |  装置用于检验消去产物 | B. | 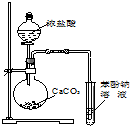 装置检验酸性:盐酸>碳酸>苯酚 | ||
| C. | 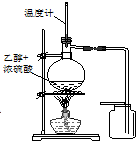 装置用于实验室制取并收集乙烯 | D. | 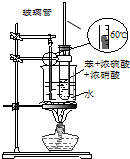 装置用于实验室制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
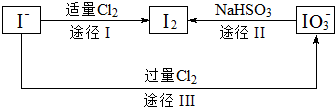
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
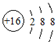 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )| A. | 核电荷数为18 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素的原子 | D. | 在化学反应中易得2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物中不可能存在非极性共价键 | |
| B. | 由电子定向移动而导电的物质一定是金属晶体 | |
| C. | 有键能很大的共价键存在的物质熔沸点一定很高 | |
| D. | 只含有共价键的物质不一定是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com