

| ||
| ||
| ||
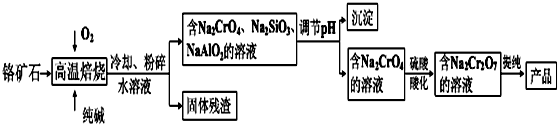
| 8 |
| 3 |
| ||
| 8 |
| 3 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 3 | 0.4 |
| 3 | 4 |
| 3 | 6 |
| 3 | 60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS水解反应:HS-+H2O═H3O++S2- | ||||
B、少量铁与热的浓硝酸反应:Fe+6HNO3(浓)
| ||||
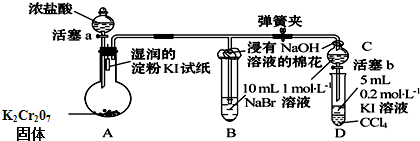
C、 如图装置中石墨电极上的电极反应为:O2+4e-+2H2O=4OH- | ||||
D、湿法炼铜的原理:Cu2S+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中溶解性:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3>NaHCO3 |
| C、同浓度溶液与足量酸反应的速度:Na2CO3>NaHCO3 |
| D、将固体溶于少量水放出的热量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该合金的熔点高于金属钠的熔点 |
| B、若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Al)>n(Na) |
| C、若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成 |
| D、等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 |
| B、酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| C、将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 |
| D、牺牲阳极的阴极保护法和外加直流电源的阴极保护法都是应用电解原理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com