
【题目】取不同质量由 Ba(OH)2和 BaCO3组成的均匀混合样品,先加适量的水溶解,然后加入100mL某浓度稀盐酸,所得CO2气 体的体积(己换算为标准状况)与加入样品的质量关系如图所示(不考虑CO2的溶解、反应及碳酸氢盐的生成)。请计算:
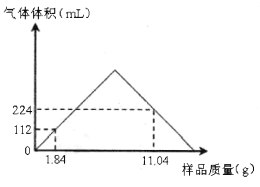
(1)混合物中Ba(OH)2和 BaCO3物质的量之比为________。
(2)稀盐酸物质的量浓度为________mo1/L。
【答案】 1:1 0.800
【解析】(1)由CO2的体积可得,其物质的量分别为0.005mol和0.010mol,由图象可知,当样品为1.84g时,盐酸过量,BaCO3完全反应,由反应BaCO3+2HCl=BaCl2+CO2↑+H2O得n(BaCO3) =0.005mol,则1.84g样品中含n(Ba(OH)2)=![]() =0.005mol,所以混合物中Ba(OH)2和 BaCO3物质的量之比为1:1;
=0.005mol,所以混合物中Ba(OH)2和 BaCO3物质的量之比为1:1;
(2)由图象可知,11.04g样品与盐酸反应时,盐酸不足;按照等比例关系,可得11.04g样品中含n(BaCO3)=n(Ba(OH)2)=0.030mol,但此时生成的n(CO2)=0.010mol,根据中和反应优先的原则,反应消耗的盐酸的物质的量为0.030mol×2+0.010mol×2=0.080mol,因此稀盐酸物质的量浓度为=![]() =0.800mo1/L。
=0.800mo1/L。


科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度最大的是( )
A.250mL2mol/L的NaOH溶液B.500mL1mol/L的盐酸
C.100mL3mol/L的硫酸D.40mL5mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)装置b的作用是___________。
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),但不用冰水进行过度冷却,原因是___________________________。
(6)以1,2二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2二溴乙烷通过反应①制得A,A通过反应②制得氯乙烯,由氯乙烯制得聚氯乙烯。
①________________(填反应类型) ②________________(填反应类型)
A________________(填该物质的电子式)
写出第一步反应①的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)质量比为16∶7∶ 6的三种气体 SO2、CO、NO,分子个数之比为________;相同条件下体积比为________。
(2)在标准状况下,1.7 g NH3所占的体积为________L,它与标准状况下________L H2S含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) ______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)0.4 mol SiH4分子中所含原子数与________g HCl分子中所含原子数相等。
(3)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为____________;一氧化碳的质量为___________。
(4)等物质的量O2和臭氧(O3),其质量之比为______________。若O2和O3质量相等,则其原子数之比为_____________。
(5)含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl-1.5 mol,K+和Na+共1.5 mol,Mg2+为0.5 mol,则SO42-的质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是 ( )。
A. 现代药物主要是人工合成的药物
B. 天然药物具有良好的药效,所以不需要进行改造
C. 药物的生物活性跟它的结构中的某些官能团有关
D. 在药物设计领域计算机应用前景广阔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol N2(g) +2O2(g) = 2NO2(g)△H = +133kJ/mol、H2O(g) = H2O(l) △H = -44kJ/mol。催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为_____________________。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
(1)①该反应自发进行的条件是__________(填“低温”、“高温”或“任意温度”),
②下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均式量保持不变 ;b.CO2和H2的体积分数保持不变;
c. CO2和H2的转化率相等 ;d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH—H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6内CO2的浓度随时间的变化_____。

(2)改变温度,使反应CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:

①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)_______K(II)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________。在其它条件不变下,若30min时只改变温度为T2 ℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”)。若30min时向容器中再充入1molCO2和1molH2O(g),则平衡_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A分子式为CxHyOz,15g A完全燃烧生成22g CO2和9gH2O。
(1)该有机物的最简式是___________________。
(2)若A是一种无色具存强烈剌激性气味的气体,具有还原性,则其结构简式是_________。
(3)A中只有一种官能团,若A和Na2CO3混合有气体放出,和醇能发生酯化反应,则A的结构简式为___________________。
(4)A中只有一种宫能团,若A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为___________________。
(5)若A其分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com