
主族元素A原子的结构示意图为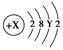 。则X、Y及该原子3p能级上的电子数分别为 ( )
。则X、Y及该原子3p能级上的电子数分别为 ( )
A.18、6、4 B.20、8、6
C.18、8、6 D.15~20、3~8、1~6
科目:高中化学 来源: 题型:
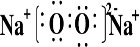
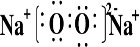


查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源:高中化学同步单元练习册第一册(高一年级) 题型:022
某主族元素A原子有5个电子层,最外层有1个电子,某主族元素B的原子的K和M层电子数之和比L层电子数多1个,回答以下问题:
(1)写出A元素的名称与符号:________,A原子的结构示意图________,写出A元素在周期表的位置________________.
(2)写出B元素的名称与符号:________,B原子的电子式________.
(3)写出A、B两元素化合的电子式________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北武汉部分重点中学高二上学期期末考试化学试卷(带解析) 题型:单选题
主族元素A原子的结构示意图为 。则X、Y及该原子3p能级上的电子数分别为 ( )
。则X、Y及该原子3p能级上的电子数分别为 ( )
| A.18、6、4 | B.20、8、6 |
| C.18、8、6 | D.15~20、3~8、1~6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com