
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
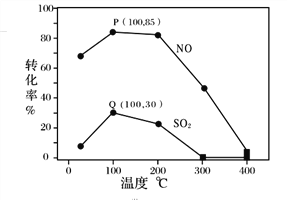
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
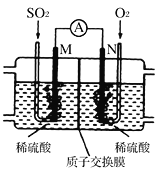
①M极发生的电极反应式为___________________。
②质子交换膜右侧的溶液在反应后pH________(填“增大”、“减小”、“不变”)。
③当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量______(填“增大”或“减小”)_______克。
【答案】 CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 BCD 0.65 0.0425mol/(L.min) 0.96 SO2+2H2O-2e- =SO42- +4H+ 增大 增大 6.2
【解析】(1)CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1)。已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJmol-1,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJmol-1,③H2O(g)=H2O(l)△H=-44.0kJmol-1,将![]() 可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=
可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=![]() =-955kJ/mol,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=-955kJmol-1;
=-955kJ/mol,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=-955kJmol-1;
(2)①反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②A.随着反应的进行,反应物的转化率逐渐增大,因此P点不一定为平衡状态点,可能是建立平衡过程中的一个点,故A错误;B.根据图像,温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零,故B正确;C.根据2O3(g) ![]() 3O2(g),其它条件不变,若缩小反应器的容积,平衡逆向移动,使得臭氧的浓度增大,反应I和反应II的平衡正向移动,NO和SO2的转化率增大,故C正确;D.根据图像,臭氧氧化过程中二氧化硫的转化率较低,不能有效地脱除SO2,二氧化硫是碱性氧化物,能够被氢氧化钠溶液吸收,故D正确;故选BCD;
3O2(g),其它条件不变,若缩小反应器的容积,平衡逆向移动,使得臭氧的浓度增大,反应I和反应II的平衡正向移动,NO和SO2的转化率增大,故C正确;D.根据图像,臭氧氧化过程中二氧化硫的转化率较低,不能有效地脱除SO2,二氧化硫是碱性氧化物,能够被氢氧化钠溶液吸收,故D正确;故选BCD;
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,发生分解反应的臭氧为2mol×10%=0.2mol,根据反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g),平衡时NO的转化率为85%,反应的臭氧为1mol×85%=0.85mol;反应Ⅱ:SO2(g)+ O3(g)
NO2(g)+O2(g),平衡时NO的转化率为85%,反应的臭氧为1mol×85%=0.85mol;反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) ,平衡时二氧化硫的转化率为30%,反应的臭氧为1mol×30%=0.30mol;最终剩余臭氧2mol-0.2mol-0.85mol-0.30mol=0.65mol;10min内NO的平均反应速率=
SO3(g)+O2(g) ,平衡时二氧化硫的转化率为30%,反应的臭氧为1mol×30%=0.30mol;最终剩余臭氧2mol-0.2mol-0.85mol-0.30mol=0.65mol;10min内NO的平均反应速率= =0.0425mol/(L·min);平衡时SO2、 O3、 SO3、O2的物质的量分别为0.7mol、0.65mol、0.3mol、0.2mol×
=0.0425mol/(L·min);平衡时SO2、 O3、 SO3、O2的物质的量分别为0.7mol、0.65mol、0.3mol、0.2mol×![]() +0.85mol+0.3mol=1.45mol,反应Ⅱ在此时的平衡常数=
+0.85mol+0.3mol=1.45mol,反应Ⅱ在此时的平衡常数=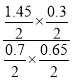 =0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
=0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
(3)①该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,通入氧气的N电极是正极,原电池放电时,氢离子由负极移向正极,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+=2H2O,负极M上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2-2e-+2H2O=4H++SO42-,故答案为:SO2-2e-+2H2O=4H++SO42-;
②质子交换膜右侧为正极区,正极上氧气得电子和氢离子反应生成水,溶液中的氢离子浓度减小,pH增大,故答案为:增大;
③质子交换膜左侧为负极区,负极上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2-2e-+2H2O=4H++SO42-,当外电路通过0.2 mol电子时,生成0.4mol氢离子,有2mol氢离子通过质子交换膜移向右侧,左侧的溶液质量增大64g/mol×0.1mol-0.2mol×1g/mol=6.2g,故答案为:增大;6.2。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO![]() 、CO
、CO![]() 中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
(2)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:

从实验可以判断,该固体粉末中一定不含有____________,它的组成可能是__________或_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药.可以通过如图所示的路线合成:

已知:RCOOH ![]() RCOCl;D与FeCl3溶液能发生显色.
RCOCl;D与FeCl3溶液能发生显色.
请回答下列问题:
(1)B→C的转化所加的试剂可能是__________ , C+E→F的反应类型是__________.
(2)有关G的下列说法正确的是_______ .
A.属于芳香烃
B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应
D.1mol G最多可以跟4mol H2反应
(3)E的结构简式为__________ .
(4)F与足量NaOH溶液充分反应的化学方程式为___________ .
(5)写出同时满足下列条件的E的同分异构体的结构简式__________ .
①能发生水解反应
②与FeCl3溶液能发生显色反应
③苯环上有两种不同化学环境的氢原子
(6)已知:工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯甲酸苯酚酯( ![]() )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用). 注:合成路线的书写格式参照如图示例流程图:__________
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用). 注:合成路线的书写格式参照如图示例流程图:__________
CH3CHO ![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3 .
CH3COOCH2CH3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A-F共6种有机物,在一定条件下,按图发生转化.

又知烃A的密度(在标准状况下)是氢气密度的13倍,试回答下列问题:
(1)有机物A的结构简式为 __________ 。有机物D中所含官能团名称为 __________ .
(2)有机物的结构简式:E. __________ ,F. __________ .
(3)C→D的反应类型属于 __________.C+E→F的反应类型属于 __________
(4)F的同分异构体中能与NaHCO3反应产生气体的有机物有 __________ 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)用双线桥法表示此反应的电子转移的方向及数目_____________
(2)该反应的氧化剂是______,还原剂是________。HCl表现 ___________性和 ____性。
(3)若消耗0.2 mol氧化剂,转移电子的物质的量是________ mol。生成氯气在标准状况下的体积是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。

(1)芳香烃:________;
(2) 卤代烃:________;
(3) 醇:________;
(4)醛:________;
(5)羧酸:________;
(6)酯:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现:工业革命前的65万年间,地球大气层中的温室气体稳定,CO2含量一直处在180 ppm~289 ppm之间,CH4含量在320 ppb~720 ppb之间,现在大气中的CO2和CH4含量分别高达380 ppm和1700 ppb,导致温室气体含量变化的主要原因是( )
①以煤为能源的机器的广泛使用 ②以石油为能源的机器的广泛使用
③以原子能为能源的核工业的发展 ④以风能、太阳能为能源的新工业的发展
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用不相对应的是
A. Na2CO3的水溶液呈碱性,医学上能用作治疗胃酸过多
B. Na2O2能分别与H2O、 CO2反应,可用作供氧剂
C. 生石灰吸水能力强,常用作袋装食品的干燥剂
D. 铝是活泼的金属单质,铝可用于冶炼某些熔点较高的金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com