
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
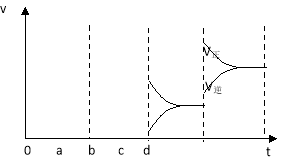
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.
2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.

【答案】(1)2mol/(L·min);1mol/(L·min); 2mol/L
(2)升温;减小 SO3 浓度;
【解析】
试题分析:(1)2min内SO2的浓度由6mol/L下降为2mol/L,二氧化硫的反应速率为:v(SO2)=(6-2)mol/L/2min=2mol/(L*min),用O2浓度变化来表示的反应速率为:v(O2)=1/2*2mol/(L*min)=1mol/(L*min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L*min),二氧化硫的反应速率为:v(SO2)=2v(O2)=2*0.5mol/(L*min)=1mol/(L*min),反应消耗的二氧化硫的物质的量浓度为:n()=1mol/(L*min)*2min=2mol/L,则2min时SO2的浓度为:4mol/L-2mol/L=2mol/L,
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为: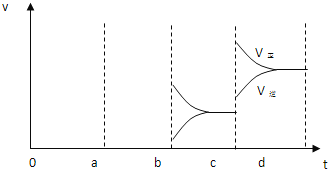 ,
,
因此,本题正确答案是:升高温度;减小SO3浓度;


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是
A. 与液溴混合后加入铁粉可发生取代反应
B. 能使酸性高锰酸钾溶液褪色
C. 1 mol苯乙烯最多能消耗2.5 molH2
D. 在催化剂存在下可以制得聚苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物大分子的叙述,正确的是
A. 组成生物大分子的单体都是以碳链为基本骨架
B. 糖类、蛋白质和核酸都是生物大分子
C. 构成生物大分子核酸的单体是核糖、磷酸和碱基
D. 生物大分子的主要功能是为细胞提供能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入300 mL 浓度为lmol/L的NaOH 溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系.下列判断不正确的是
A. n(Na+):n(C1-)可能为7:3
B. n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2
C. 参加反应氯气物质的量为0.15mol
D. 反应中转移电子物质的量n的范围:0.15mol<n<0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)9.8gH2SO4的物质的量是;2.0molH2O的质量是 .
(2)含Al3+5.4g的硫酸铝的物质的量为 , 其中含SO42﹣个.
(3)某二价金属1.6g在氧气中完全燃烧生成2g氧化物,则该金属的相对原子量 .
(4)6.02×1023个CO2与molH2质量相等,与gSO2含有的氧原子数相等.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去). 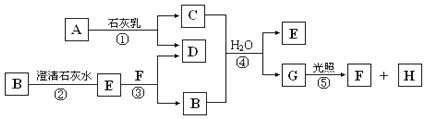
请回答以下问题:
(1)E是(填化学式),G是(填名称);
(2)C物质在日常生活中可作;
(3)写出反应①的化学方程式; C与浓盐酸反应,可以生成A气体,写出反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.NaClO能使蛋白质变性,可用于配制消杀剂
B.Na2CO3易溶于水,可用于去除餐具表面油污
C.FeCl3水解显酸性,可用于催化H2O2的分解
D.醋酸具有挥发性,可用于溶洗热水器内水垢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com