
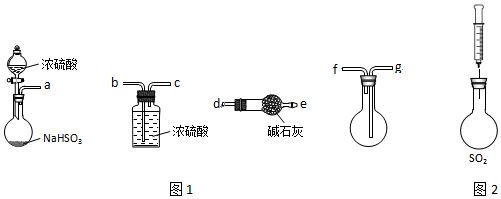
| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有①氧化性 |
| 用注射器将 ②FeCl3溶液溶液注入充满SO2的烧瓶 | ③溶液由棕黄色变成浅绿色 | +4价S有还原性,反应的离子方程式为④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
分析 (1)亚硫酸的酸性弱于硫酸,用图1装置制备纯净的SO2,NaHSO3与浓H2SO4反应,生成硫酸钠或硫酸氢钠、水、二氧化硫;从溶液中制取二氧化硫,制取的二氧化硫中含有水蒸气,需用浓硫酸进行干燥,收集采用向上排空气法收集,二氧化硫为有毒的气体,是大气污染物,需进行尾气处理,据此分析选择装置的连接顺序;
(2)①硫化氢和二氧化硫会发生价态归中反应生成硫单质,所以产生乳白色浑浊,二氧化硫中+4价的硫降低为0价,说明二氧化硫中+4价的硫具有氧化性;
②说明+4价的硫具有还原性,需与氧化性的物质反应,需在提供的试剂中选择氧化剂,可选择氯化铁,+3价的铁具有氧化性,氯化铁为棕黄色溶液,氯化亚铁为浅绿色溶液,据此分析解答;
(3)通过测定溶液中亚硫酸根离子、硫酸根离子的量来测定溶液中(NH4)2SO3的氧化率(α),方案1测定溶液中亚硫酸根离子的量,方案2测定溶液中硫酸根离子的量.
解答 解:(1)亚硫酸的酸性弱于硫酸,NaHSO3与浓H2SO4反应,生成硫酸钠或硫酸氢钠、水、二氧化硫,该反应方程式为:2NaHSO3+H2SO4═Na2SO4+2H2O+2SO2↑或NaHSO3+H2SO4═NaHSO4+H2O+SO2↑,从溶液中制取二氧化硫,制取的二氧化硫中含有水蒸气,二氧化硫为酸性气体,可用浓硫酸进行干燥,所以a→b,二氧化硫密度大于空气,收集采用向上排空气法收集,需长管进,短管出,所以c→g,二氧化硫为有毒的气体,是大气污染物,需进行尾气处理,用碱石灰吸收,所以f→d;
故答案为:2NaHSO3+H2SO4═Na2SO4+2H2O+2SO2↑或NaHSO3+H2SO4═NaHSO4+H2O+SO2↑;b→c→g→f→d;
(2)①氧化还原反应中元素化合价降低的元素具有氧化性,化合价升高的元素具有还原性,硫化氢和二氧化硫反应,反应方程式为:2H2S+SO2=3S↓+2H2O,二氧化硫中+4价的硫降低为0价,说明二氧化硫中+4价的硫具有氧化性,硫化氢中-2价的硫升高为0价,具有还原性,两者发生价态归中反应生成硫单质,所以产生乳白色浑浊,
故答案为:氧化;
②说明+4价的硫具有还原性,需与氧化性的物质反应,需在提供的试剂中选择氧化剂,可选择氯化铁,+3价的铁具有氧化性,铁离子与二氧化硫发生氧化还原反应,发生2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,氯化铁为棕黄色溶液,氯化亚铁为浅绿色溶液,可观察到溶液由黄色变浅绿色,
故答案为:FeCl3溶液;溶液由棕黄色变成浅绿色;2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)方案1:测定溶液中亚硫酸根离子的量,取20.00mL反应后的溶液于锥形瓶中,用浓度为Cmol/L酸性高锰酸钾溶液滴定,5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O,重复滴定三次,平均消耗高锰酸钾的体积为VmL,剩余的亚硫酸根离子的物质的量为:$\frac{5}{2}$(CV×10-3)mol,则氧化率(α)=$\frac{20×1{0}^{-3}{C}_{0}-x}{20×1{0}^{-3}{C}_{0}}=\frac{8{C}_{0}-CV}{8{C}_{0}}$,
方案2:测定溶液中硫酸根离子的量,向反应后的溶液中加入过量的盐酸,先将剩余的亚硫酸根离子除掉,再加入足量的氯化钡溶液,生成硫酸钡沉淀,将沉淀过滤、洗涤、干燥、称量,质量为mg.则氧化率(α)=$\frac{m}{233•0.1{C}_{0}}$=$\frac{m}{23.3{C}_{0}}$.
故答案为:方案1:取20.00mL反应后的溶液于锥形瓶中,用浓度为Cmol/L酸性高锰酸钾溶液滴定,重复滴定三次,平均消耗高锰酸钾的体积为VmL;方案2:向反应后的溶液中加入过量的盐酸,再加入足量的氯化钡溶液,将沉淀过滤、洗涤、干燥、称量,质量为mg.;$\frac{8{C}_{0}-CV}{8{C}_{0}}$或$\frac{m}{23.3{C}_{0}}$.
点评 本题考查了二氧化硫的实验室制备和性质的检验,明确制备原理和各仪器作用、二氧化硫的性质是解题关键,注意二氧化硫的还原性、氧化性,题目难度中等,试题培养了学生的化学实验能力.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④⑤ | C. | ①④⑥ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl═H++Cl- | B. | Ba(OH)2═Ba2++2OH- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0g草酸中共用电子对数目为0.9NA | |
| B. | 9.0g草酸被NaClO氧化生成CO2,转移的电子数为0.2NA | |
| C. | 9.0g草酸溶于水,其中C2O${\;}_{4}^{2-}$和HC2O${\;}_{4}^{-}$的微粒数之和为0.1NA | |
| D. | 9.0g草酸受热完全分解为CO2、CO、H2O,标准状况下测得生成的气体体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制的氢氧化铜不能区分乙醇,乙酸 | |
| B. | (CH3)2CHCH(CH3)2的名称是2,3-二甲基丁烷 | |
| C. | 近日,南充周边地市发生人感染H7N9禽流感病毒病例,该病毒可被高温和紫外线杀灭,利用了蛋白质变性的原理 | |
| D. | CH4和C10H22互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:rW<rX<rY | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中,Z的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | NaOH溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H 1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(s)+O2(g)=SO2(g)△H 1; S(g)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H 1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H 1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com