
【题目】海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
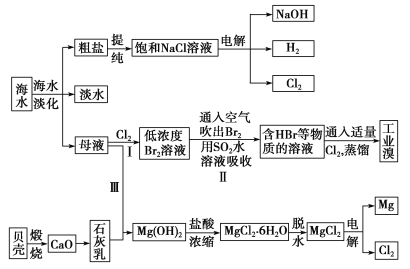
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是________(填编号)。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_______________________。
(3)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入MgCl2溶液,充分搅拌后经________(填操作方法)可得纯净的Mg(OH)2。
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填字母)。
A.H2 B.CO2 C.N2 D.O2 E.水蒸气
【答案】③②④①(或其他合理答案) 富集溴元素 Br2+SO2+2H2O=4H++SO42-+2Br- 过滤、洗涤 A
【解析】
降低海水温度得到粗盐和母液,通过CaCO3![]() CaO+CO2↑、CaO+H2O=Ca(OH)2、Mg2++2OH-=Mg(OH)2↓获取Mg(OH)2,将Mg(OH)2加盐酸浓缩结晶得到MgCl2·6H2O,为防止镁离子水解,在HCl氛围中将MgCl2·6H2O加热蒸干得到无水MgCl2,电解熔融氯化镁得到Mg单质;从母液中得到NaBr溶液,向NaBr溶液中通入Cl2,发生反应2Br-+Cl2=2C1-+Br2,向低浓度Br2溶液中通人SO2,发生反应Br2+SO2+2H2O=4H++SO42-+2Br-,向含有Br-的浓溶液中通入Cl2,得到高浓度Br2;将粗盐溶解得到溶液,向溶液中加入沉淀剂将镁离子、硫酸根离子、钙离子除去,得到饱和NaCl溶液,电解饱和NaCl溶液得到氯气、氢气和NaOH,据此分析解答。
CaO+CO2↑、CaO+H2O=Ca(OH)2、Mg2++2OH-=Mg(OH)2↓获取Mg(OH)2,将Mg(OH)2加盐酸浓缩结晶得到MgCl2·6H2O,为防止镁离子水解,在HCl氛围中将MgCl2·6H2O加热蒸干得到无水MgCl2,电解熔融氯化镁得到Mg单质;从母液中得到NaBr溶液,向NaBr溶液中通入Cl2,发生反应2Br-+Cl2=2C1-+Br2,向低浓度Br2溶液中通人SO2,发生反应Br2+SO2+2H2O=4H++SO42-+2Br-,向含有Br-的浓溶液中通入Cl2,得到高浓度Br2;将粗盐溶解得到溶液,向溶液中加入沉淀剂将镁离子、硫酸根离子、钙离子除去,得到饱和NaCl溶液,电解饱和NaCl溶液得到氯气、氢气和NaOH,据此分析解答。
(1) Ca2+、Mg2+、SO42-等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,NaOH溶液的作用主要是除去粗盐中的Mg2+,加入顺序只要在加入盐酸之前即可,所以正确顺序为②④③①或③②④①或②③④①;
(2)根据分析,步骤Ⅰ中获得Br2浓度较低,步骤Ⅱ中又将Br2还原为Br-,其目的是富集溴元素;步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,SO2具有还原性,Br2具有氧化性,二者在溶液中发生氧化还原反应生成硫酸和溴化氢,离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-;
(3)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入MgCl2溶液,使溶解度较小的Ca(OH)2转化为溶解度更小的Mg(OH)2,发生的离子反应为:Ca(OH)2+ Mg2+=Mg(OH)2+ Ca2+,则充分搅拌后过滤、洗涤即可得纯净的Mg(OH)2;
(4)镁蒸气的温度较高,高温下,镁单质可与氧气,氮气、二氧化碳、水蒸气发生反应,故答案选A。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.![]() 与水反应:
与水反应:![]() +
+![]() =
=![]()
B.铁与稀硫酸反应:2Fe+6![]() =2
=2![]() +3
+3![]() ↑
↑
C.![]() 溶液和
溶液和![]() 溶液反应:
溶液反应:![]() ↓
↓
D.CaCO3和稀硝酸反应:CaCO3+![]() =Ca2++
=Ca2++![]() ↑+
↑+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法不正确的是( )
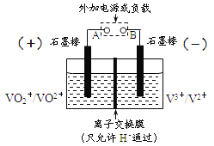
A. 充电时,每转移1mol电子,电解液中n(H+)的变化量为2mol
B. 充电时,阴极电解液pH升高
C. 放电时,右槽发生氧化反应
D. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ΔH 2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH 3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的ΔH =______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =-681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为T K时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =-681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为T K时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=___________mol/(L·min)。
②30 min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,可采用NSR(NOx储存还原)进行处理,NOx的储存和还原在不同时段交替进行,如图a所示。

①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
②NOx储存转化为Ba(NO3)2过程中,参加反应的NO和O2的物质的量之比为_________。
(4)有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,保持恒压在不同温度下发生该反应,并分别在t秒时测得NO的转化率,如图所示:
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,保持恒压在不同温度下发生该反应,并分别在t秒时测得NO的转化率,如图所示:

①由图可知,1050 K前反应中NO的转化率随温度升高而增大,其原因为 _______________;在1100 K时,CO2的体积分数为___________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp),在1050K1.1×106 Pa时,该反应的化学平衡常数Kp=______________________。
[已知:气体分压(P分)=气体总压(P)×体积分数]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属清除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,该反应中氧化剂和还原剂的物质的量之比为_____。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色沉淀生成。该反应的离子方程式为__________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mgL-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,脱硝后N元素以NO3-形式存在,其关系如下图所示:
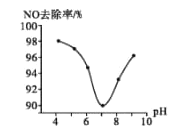
①实验中使用的ClO2溶液的物质的量浓度为______(保留三位有效数字);要使NO的去除率更高,应控制的条件是_________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaClO2,写出碱性条件下NaClO2脱除NO反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)仔细观察实验装置,图中是否缺少一种玻璃仪器,如果缺少,缺少的是______________(填仪器名称,如果不缺少,此空不填),图中是否有不妥之处,如果有请指出:________________________(如果没有,此空不填)。
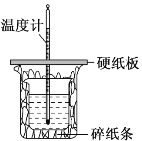
(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将______(填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”或“不相等”),简述理由:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现铂的两种化合物a和b
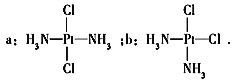
实验测得a和b具有不同的特性,a具有抗癌作用,而b没有。则下列关于a、b的叙述正确的是
A. a和b属于同一种物质
B. a和b属于手性异构体
C. a和b的空间构型是四面体
D. a和b的空间构型是平面四边形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
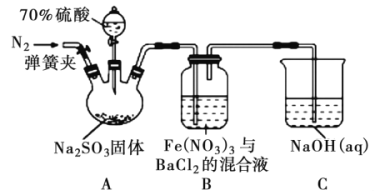
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com