
【题目】实验室制备乙炔时,气体中常含有杂质,影响其性质的检验。如图A为除杂装置,B为性质检验装置,回答下列问题:
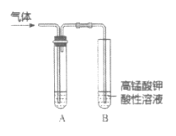
(1)实验室中制备乙炔的化学方程式:________。
(2)A中试剂:_______。
【答案】CaC2+2H2O=Ca(OH)2+C2H2↑ CuSO4溶液
【解析】
(1)实验室中用电石和水反应制乙炔;
(2)A中试剂主要除杂质气体硫化氢、磷化氢等,排除它们对乙炔与酸性高锰酸钾溶液反应的干扰。
(1) 电石和水反应制乙炔,电石的主要成分是碳化钙,与水反应生成氢氧化钙和乙炔,反应方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑;
答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)因为电石含杂质硫化钙、磷化钙,与水反应生成的乙炔中含有硫化氢,磷化氢等,有毒且均可使高锰酸钾溶液褪色,会干扰乙炔与酸性高锰酸钾溶液反应,因此用硫酸铜溶液除去硫化氢,磷化氢杂质气体;
答案为:CuSO4溶液。


科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是H3AsO4水溶液中含砷的各物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系。下列说法错误的是
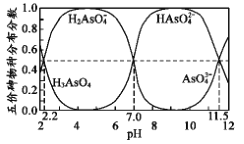
A.NaH2AsO4溶液呈酸性
B.向NaH2AsO4溶液滴加 NaOH 溶液过程中,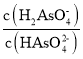 先增加后减少
先增加后减少
C.H3AsO4和HAsO42-在溶液中不能大量共存
D.Ka3( H3AsO 4) 的数量级为10-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe2+ + Cr3+![]() Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
Fe3 + + Cr2+,工作示意图如图。下列说法错误的是

A.放电时a电极反应为 Fe 3++e- =Fe2+
B.充电时b电极反应为 Cr3++e- =Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20.00mL 0.100 mol·L![]() HX中滴加0.100 mol·L
HX中滴加0.100 mol·L![]() NaOH过程中,pH变化如下图所示。
NaOH过程中,pH变化如下图所示。
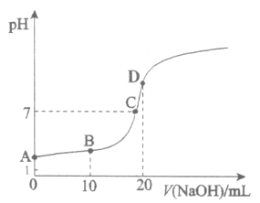
(1)写出HX的电离方程式:__________。
(2)下列有关B点溶液的说法正确的是__________(填字母序号)。
a. 溶质为:HX、NaX
b. 微粒浓度满足:c(Na+)+c(H+)=c(X-)+c(OH-)
c. 微粒浓度满足:c(Na+)=c(HX)+c(X-)
d. 微粒浓度满足:c(X-)>c(Na+)>c(H+)>c(OH-)
(3)A、C两点水的电离程度:A__________C(填“>”、“<”或“=”)。
(4)C点对应离子浓度由大到小的顺序为__________。
(5)用离子方程式解释D点溶液pH>7的原因:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l)![]() 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。

①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____(写化学式),反应达到平衡时的平均反应速率v(N2) =_________。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____KD,B 点N2 的转化率=_________(保留3位有效数字)。
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图丙:

负极反应式为__________,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
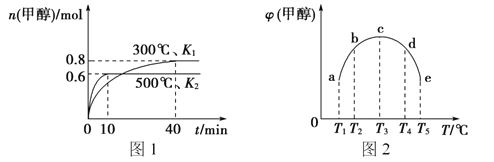
A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备和研究乙炔性质的实验装置图。下列说法不正确的是
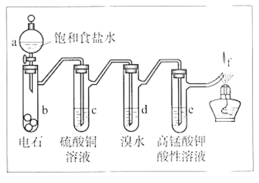
A.制备乙炔的反应原理是CaC2+2H2O→Ca(OH)2+C2H2↑
B.c的作用是除去影响后续实验的杂质
C.e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
D.f处观察到的现象是安静燃烧,火焰呈淡蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com