
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属形成非极性键,不同非金属形成极性键,在溶液中能够发生部分电离的电解质是弱电解质,以此来解答.
解答 解:①HCl只含有极性键,是共价化合物,在溶液中完全电离属于强电解质;
②NaOH 存在离子键和极性键,是离子化合物,在溶液中完全电离属于强电解质;
③Cl2只含有非极性键,是单质,不是电解质;
④H2O只含有极性键,是共价化合物,在溶液中部分电离属于弱电解质;
⑤NH4Cl存在离子键和极性键,是离子化合物,在溶液中完全电离属于强电解质;
⑥P4 只含有非极性键,是单质,不是电解质;
⑦NH3•H2O只含有极性键,是共价化合物,在溶液中部分电离属于弱电解质;
⑧Na2O2存在离子键和非极性键,是离子化合物,属于强电解质;
⑨HClO只含有极性键,是共价化合物,在溶液中部分电离属于弱电解质;
⑩CaO只含有离子键,是离子化合物,是强电解质;
⑪HF只含有极性键,是共价化合物,在溶液中部分电离属于弱电解质;
⑫MgCl2只含有离子键,是离子化合物,是强电解质;
(1)存在离子键的是②⑤⑧⑩⑫;故答案为:②⑤⑧⑩⑫;
(2)属于共价化合物的是①④⑦⑨⑪;故答案为:①④⑦⑨⑪;
(3)存在极性键的是①②④⑤⑦⑨⑪;故答案为:①②④⑤⑦⑨⑪;
(4)存在非极性键的是③⑥⑧;故答案为:③⑥⑧;
(5)属于弱电解质的是④⑦⑨⑪;故答案为:④⑦⑨⑪.
点评 本题考查化学键和弱电解质的判断,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
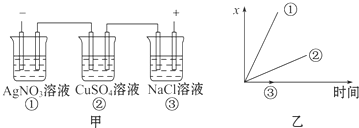
| A. | 各电解池析出气体体积总数的变化 | B. | 各电解池阳极质量的增加 | ||
| C. | 各电解池阴极质量的增加 | D. | 各电极上放电的离子总数的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③② | B. | ①②③ | C. | ②③① | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 稳定性:HF>HCl>HBr>HI | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com