
分析 根据n=$\frac{V}{{V}_{m}}$计算出n(HCl),根据m=nM计算m(HCl),盐酸的质量分数=$\frac{m(HCl)}{m(HCl)+m(水)}$×100%,最后根据c=$\frac{1000ρω}{M}$计算所得溶液的物质的量浓度.
解答 解:标准状况下360mLHCl的物质的量为:n(HCl)=$\frac{360L}{22.4L/mol}$≈16.07mol,该氯化氢的质量为:m(HCl)=16.07mol×36.5g•mol-1=586.6g,
盐酸的质量分数为:w=$\frac{586.6g}{586.6g+1000g}$×100%≈37.0%,
该溶液的物质的量浓度为:c(HCl)=$\frac{1000ρω}{M}$=$\frac{1000×1.18×37%}{36.5}$mol/L=12.0mol/L,
答:盐酸的质量分数为37.0%,物质的量浓度为12.0mol/L.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量浓度、溶质质量分数的概念及表达式为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积、物质的量浓度之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
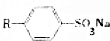
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 0.3mol/L的硫酸溶液 | B. | 30mL 0.2mol/L的硫酸溶液 | ||
| C. | 20mL 0.2mol/L的硫酸溶液 | D. | 10mL 0.4mol/L的硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
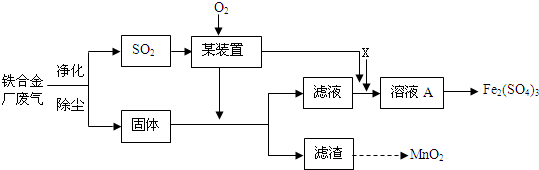
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.062 mol/L | B. | 0.62 mol/L | C. | 6.2mol/L | D. | 62mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com