

分析 Ⅰ、(1)由于该实验中有气体通过装置参加 反应,所以实验开始要检验装置的气密性;
(2)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水以及二氧化碳;
(3)反应后装置B增重1.35g,即氢气和氧化铁反应后生成的水的质量,可以根据氧守恒来计算;
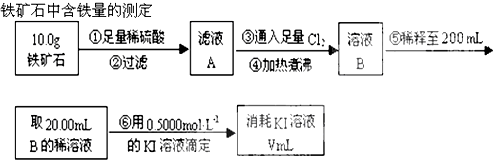
Ⅱ、铁矿石先用足量的稀硫酸溶解,过滤除去杂质,得到只含铁的离子的溶液,再通氯气将溶液中的铁的离子氧化成三价铁离子,再用碘化钾来滴定,据此分析计算;
(1)煮沸可以将水中的气体赶跑;
(2)根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
(3)根据元素守恒和化学反应方程式进行计算;
Ⅲ.Ⅰ中装置B增重1.35g为生成水的质量,根据氧元素守恒5g矿石中计算n(O),Ⅱ中步骤⑥发生2Fe3++2I-=2Fe2++I2,根据消耗KI溶液体积计算n(Fe3+),根据Fe元素守恒计算10g矿石中n(Fe),据此确定氧化物化学式.
解答 解:(1)由于该实验中有气体通过装置参加 反应,所以实验开始要检验装置的气密性,
故答案为:检验装置的气密性;
(2)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,所以C装置要防止防止空气中的水蒸气和CO2进入B中,影响测定结果,
故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;(3)测的反应后装置B增重1.35g,根据反应的实质,增加的是水的质量,根据质量守恒定律,所以铁矿石中氧的百分含量是:$\frac{\frac{1.35}{18}×16}{5.0}$×100%=24%,
故答案为:24%;
Ⅱ、(1)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸后可以降低氯气的溶解度,赶走溶液中溶解的过量的Cl2,
故答案为:赶走溶液中溶解的过量的Cl2;
(2)a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;
b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,不能确定是否达到滴定终点,故b错误;
c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;
d.锥形瓶不需要用待测液润洗,故d正确;
e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;
f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确.
故答案为:df;
(3)根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即:0.4000mol•L-1×0.025L=c(Fe3+)×0.02L,解得c(Fe3+)=0.5mol•L-1,所以铁元素的百分含量为:$\frac{0.5mol/L×0.25L×56g/mol}{10g}$×100%=70%,
故答案为:70%;
Ⅲ.铁的质量分数是70%,氧元素的质量分数是24%,
所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:$\frac{70}{56}$:$\frac{24}{16}$=5:6,
铁的氧化物的化学式为:Fe5O6,
故答案是:Fe5O6 .
点评 本题考查了探究铁矿石中氧元素和铁元素的含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题综合性强,理论和实践的联系紧密,要求学生必须认真、细致的审题,联系所学过的知识和技能,全面细致的思考才能得出正确的结论.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 氢氧化钡溶液中滴加稀硫酸:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为9的氧原子符号为16O | |
| B. | 某元素的一种原子质量数为X则该元素的相对原子质量为X | |
| C. | H、D、T三种核素化学性质不相同 | |
| D. | 次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在的离子是Na+、SO32-、NO3-、AlO2- | |
| B. | 一定存在的离子是Na+、SO32-、CO32-、AlO2- | |
| C. | 可能存在的离子是Al3+、CO32- | |
| D. | 可能存在的离子是CO32-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器的容积 | B. | 升高体系的温度 | C. | 移走部分CO2 | D. | 通入大量O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-890kJ | |
| B. | 表示H2S气体燃烧热的热化学方程式为:2H2S(g)+O2(g)═2S(s)+2H2O(l)△H=-136kJ/mol | |
| C. | 2mol H2燃烧得水蒸气放热484 kJ,则:H2O(g)═H2(g)+1/2O2(g)△H=+242 kJ/mol | |
| D. | 2NO+O2=2NO2 △H=+116.2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去MgCl2溶液中少量的FeCl3,可选用MgO | |
| B. | Na久置与空气中最终生成NaHCO3 | |
| C. | 铝、铁、铜在空气中长时间放置,表面均只生成氧化物 | |
| D. | 向NaOH溶液中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com