
���ܵ�Ԫ���ڵؿ��еķ�Ƚϵ�(��Ҫ�������ε���ʽ����)��������Ԫ���н���31λ�����Ǵ������зḻ�ĵ�������Ϊ��������Ĺ㷺Ӧ���ṩ�˿��ܡ�
��1�������ĵ���ʽΪ ���������ܽ��е��Ĺ̶���д����Ӧ����ʽ ��
��2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������� (������)����ˮ������ղ���Ϊ ��
��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3����д�������ӷ���ʽ�� ��
��4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬�õ���״����NO 11.2 L��������Һ�м��������ˮ����ַ�Ӧ����ˡ�����Һ������ɫ����Ϊ���е�����(�ѧʽ)�� ��������������Ϊ7.8g����Ͻ������Ϊ g��
��1��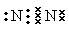 N2+O2
N2+O2 2NO�� ��2�������ʣ������
2NO�� ��2�������ʣ������
��3��NH4++2O2 NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1
NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1
���������������1����N2����������Nԭ�ӹ������Ե��ӡ����Ե����ĵ���ʽΪ ���ڵ��������N2��O2������Ӧ�õ�NO����Ӧ�ķ���ʽΪN2+O2
���ڵ��������N2��O2������Ӧ�õ�NO����Ӧ�ķ���ʽΪN2+O2 2NO����2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ���������������İ��������ͨ����ˮ���϶��ɡ������ˮ������ղ���Ϊ�����ᡣ��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3������Ӧ�����ӷ���ʽNH4++2O2
2NO����2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ���������������İ��������ͨ����ˮ���϶��ɡ������ˮ������ղ���Ϊ�����ᡣ��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3������Ӧ�����ӷ���ʽNH4++2O2 NO3-+H2O+2H+����4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬������Ӧ��3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O.������Һ�м��������ˮʱ�����ڰ�ˮΪ��������ܽ������Al(OH)3���������Է�����Ӧ��Al(NO3)3+3NH3��H2O= Al(OH)3��+ 3NH4NO3��Cu(NO3)2+6NH3��H2O=[Cu(NH3)4](OH)2��2H2O+ 2NH4NO3.����Һ������ɫ����Ϊ���е�����ͭ�������ӡ����İ���ͭ����[Cu(NH3)4] 2-��n(Al(OH)3)=7.8g��78g/mol="0.1mol." m(Al)=2.7g.���ݷ���ʽ Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O��֪Al������NO�����ʵ���Ϊ0.1mol,��Cu������NO�����ʵ���Ϊ0.5mol-0.1mol=0.4mol.�ɷ���ʽ 3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��֪Cu�����ʵ���Ϊ0.6mol.m(Cu)=" 0.6mol" ��64g/mol=38.4g.���ԺϽ������Ϊ38.4g=41.1g��
NO3-+H2O+2H+����4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬������Ӧ��3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O.������Һ�м��������ˮʱ�����ڰ�ˮΪ��������ܽ������Al(OH)3���������Է�����Ӧ��Al(NO3)3+3NH3��H2O= Al(OH)3��+ 3NH4NO3��Cu(NO3)2+6NH3��H2O=[Cu(NH3)4](OH)2��2H2O+ 2NH4NO3.����Һ������ɫ����Ϊ���е�����ͭ�������ӡ����İ���ͭ����[Cu(NH3)4] 2-��n(Al(OH)3)=7.8g��78g/mol="0.1mol." m(Al)=2.7g.���ݷ���ʽ Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O��֪Al������NO�����ʵ���Ϊ0.1mol,��Cu������NO�����ʵ���Ϊ0.5mol-0.1mol=0.4mol.�ɷ���ʽ 3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��֪Cu�����ʵ���Ϊ0.6mol.m(Cu)=" 0.6mol" ��64g/mol=38.4g.���ԺϽ������Ϊ38.4g=41.1g��
���㣺�������ʽ�����ӷ���ʽ����ѧ����ʽ����д���Ͻ���ij�ɷֺ����ļ����֪ʶ��


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д� Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
1gN2��a�����ӣ����ӵ������ɱ�ʾΪ�� ��
| A��a/28mol-1 | B��a mol-1 | C��28a mol-1 | D��a/14 mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��6�֣���9mol/L��Ũ����ϡ�ͳ� 0��9mol/L��ϡ���� 100mL ���ش��������⣺
��1�����Ʋ����ɷֽ�����¼�����������ȷ�IJ���˳����_____________________
A ������ƿ��ע����������ˮ������Ƿ�©ˮ
B ����������ˮϴ���ձ���������������Һע������ƿ�����ظ���������
C ������ȴ��ϡ����ע���Ѽ�鲻©ˮ������ƿ��
D ���ݼ��㣬����Ͳ��ȡһ�������Ũ����
E����Ũ�������ձ�������ע��ʢ������ˮ��С�ձ��У��������ò���������
F����������ƿ���ӣ���ҡ��
G���ý�ͷ�ιܵμ�����ˮ��ʹ��Һ����ǡ����̶�����
H������������ƿ��С�ĵؼ�����ˮ��ʹҺ��ӽ��̶���1~2 cm
��2�����ʵ������98����Ũ����(�ܶ�Ϊ1��8g��cm-3 ) ����3�� 6 mol��L-1��ϡ����250mL����������Ũ��������Ϊ_____________mL��
��3�����ڴ������, ʹ�õ���Ũ�����ݱ���ȷ��ƫ�����___________����д��ţ���
A ʹ������ƿ������Һʱ, ����Һ�涨�ݺ�������Һ��Ũ��
B û��������ˮϴ�ձ�2-3�Σ�����ϴҺ��������ƿ��
C ����ƿ������ˮϴ����û�к��
D ����ʱ���μ�����ˮ����ʹҺ���Ը��ڿ̶��ߣ�����������ˮʹҺ�氼����̶�������
E������õ���Һ����������ˮϴ����δ�ɵ��Լ�ƿ�б���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij����NH4HCO3�л�������(NH4)2CO3���ֲ������з����ⶨ�õ�����(NH4)2CO3��������������ȡ5.7 g��Ʒ��2.0 mol��L��1 NaOH��Һ��ϣ���ȫ�ܽ���¼���ʹ���ַ�Ӧ(���¶�����β��ֽ�)����ʹ���ɵİ���ȫ�����������գ���ð���������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺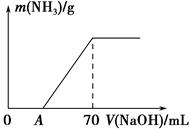
(1)A��ǰ��Ʒ��NaOH��Ӧ�����ӷ���ʽΪ ��
(2)Ϊʹ���ɵİ�������������ʱ����������������ѡ������װ���е� (����ĸ���)��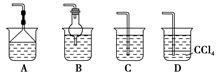
(3)��Ʒ��(NH4)2CO3������������ %(����һλС��)��
(4)��V(NaOH)��50 mLʱ������NH3������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��84����Һ������Чɱ�����H1N1������ijͬѧ������һƿijƷ�ơ�84����Һ����
������������Ϻ�����Һ��װ˵���õ�������Ϣ��
��84����Һ������25% NaClO��1 000 mL���ܶ�1.19 g��cm��3��ϡ��100��(�����)��ʹ�á������������Ϣ�����֪ʶ�ش��������⣺
(1)�á�84����Һ�������ʵ���Ũ��Ϊ________mol��L��1��
(2)��ͬѧȡ100 mL��Ʒ�ơ�84����Һ��ϡ�ͺ�����������ϡ�ͺ����Һ��c(Na�� )��________mol��L��1(����ϡ�ͺ���Һ�ܶ�Ϊ1.0 g��cm��3)��
(3)��ͬѧ���ĸ�Ʒ�ơ�84����Һ�����䷽������NaClO��������480 mL��25% NaClO������Һ������˵����ȷ����________��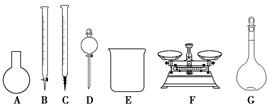
| A����ͼ��ʾ�������У��������Dz���Ҫ�ģ�����һ�ֲ������� |
| B������ƿ������ˮϴ����Ӧ��ɲ���������Һ���� |
| C�����ù������ƷNaClO�����ƿ��ܵ��½��ƫ�� |
| D����Ҫ������NaClO��������Ϊ143 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵ��������480 mL 0��600 mol��L��1��NaCl��Һ�������²������裺
�ٰѳ����õ�NaCl�������С�ձ��У�����������ˮ�ܽ�
�ڰѢ�������ҺС��ת������ƿ��
�ۼ���������ƿ�м�����ˮ��Һ���̶���1 cm��2 cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ����̶�������
������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ת������ƿ��������ҡ��
�ݽ�����ƿƿ�����������ҡ��
����д���пհף�
(1)�����������ȷ˳��Ϊ(�����) ��
(2)ʵ���������¹�������ƿ����100 mL����250 mL����500 mL����1000 mL����ʵ��ѡ��(�����) ��
(3)��ʵ���õ��Ļ���ʵ������������ƿ���������⣬���� ��
(4)��Ҫʹ�ò������IJ����� (������)��������Ϊ ��
(5)��������(�ƫ�ߡ���ƫ�͡�����Ӱ�족)
�ٳ���NaClʱ�����뵹��(1 g����������) ��
��ijͬѧ�۲�Һ����������ͼ��ʾ����������ҺŨ�Ƚ��к�Ӱ�� ��
��û�н��в�������� ��
�ܼ�����ˮʱ���������˿̶��ߣ������ý�ͷ�ιܽ������ˮ���� ��
������ƿ��ԭ��������ˮ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����������ʼ�ת���Ŀ�ͼ���ش��й����⣻
`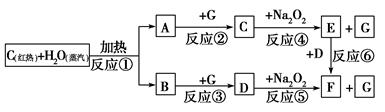
(1)�ɷ�Ӧ�ٲ�����A��B�����Ĺ�ҵ������________��
(2)д����ͼ��D��E�Ļ�ѧʽ��D________��E________��
(3)���2 mol Na2O2������ˮ������Ӧ���ɵñ�״��������������________L��ͬʱ��Ӧ��ת�Ƶ���������____________��(NA��ʾ�����ӵ�����)
(4)���A��B�������7.8 g������G��ַ�Ӧ��ͨ������Na2O2�㣬��ʹNa2O2����________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��һ���¶Ⱥ�ѹǿ�£�1���X2(g)��3���Y2(g)��������2���Z(g)����Z����Ļ�ѧʽ��________��
(2)��ͬ�¡�ͬѹ�£�ʵ����CO��N2��O2��������Ļ��������ܶ���H2��14.5��������O2����������Ϊ________��������CO��N2�����ʵ���֮��Ϊ1��1��������������Ԫ�ص���������Ϊ________��
(3)��ͬ�����£�ijCl2��O2�������100 mLǡ����150 mL H2��������HCl��H2O������������Cl2��O2�������Ϊ________����������ƽ����Է�������Ϊ________��
(4)����m gij���壬����Ħ������ΪM g��mol��1����
�ٸ���������1 Lˮ��(�����Ƿ�Ӧ)������Һ�����ʵ���������Ϊ________��
�ڸ���������ˮ���γ�V L��Һ������Һ�����ʵ���Ũ��Ϊ______ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��2.0mol/LCuSO4��Һ��1.0mol/LH2SO4��Һ�������ϣ������Ϻ���Һ�������������Һ�����֮�ͣ���
��1����Һ��H+�����ʵ���Ũ��Ϊ ��SO42-�����ʵ���Ũ��Ϊ ��
��2��������Һ�м������������ۣ����㹻����ʱ���������ʣ�ࡣ��ʱ����Һ�е�Fe2+���ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com