
【题目】Ga、As、Al、C的相关化合物在化工和医学领域有着广泛的应用。回答下列问题:
(1)写出基态Ga原子的核外电子排布式:_________,有_____个未成对电子。
(2)合金砷化镓在现代工业中被广泛应用,Ga、As电负性由大到小排序为______________。
(3)1个丙二烯分子中σ键总数为___个,C原子的杂化方式为______。分子中的大π键可以用符号пmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为п66),则丙二烯中的大π键应表示为____________。
(4)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:

①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0, 0, 0);B为(1/2,1/2,0);C为(1,0,1)。则D原子的坐标参数为_________________。
②已知氮化镓晶胞的边长为a nm,其密度为d g/cm3,则阿伏加德罗常数NA =____(用a、d表示)
【答案】 [Ar] 3d104s24p1 1 As>Ga 6 sp2 sp п43 (3/4,3/4,3/4) 336/a3d×1021
【解析】(1)Ga为31号元素,根据电子构造原理可知其电子排布式为[Ar]3d104s24p1,4p1轨道上有一个未成对的电子。
(2)Ga、As位于同一周期,As最外层电子数大于Ga,所以As的非金属性大于Ga,即电负性As>Ga。
(3)丙二烯的结构简式为CH2=C=CH2,单键为σ,碳碳双键中有一个σ键,所以总共的σ键个数为6个;该分子中有两种碳原子,CH2的碳上含有3个σ键,所以为sp2杂化,中间碳含有2个σ键,所以为sp杂化;丙二烯中参与形成大π键的原子个数为3个,CH2=C=CH2含有2个普通π键,形成一个π键的每一个碳原子提供一个单电子,所以每形成1个π键碳原子提供两个电子,2个π键则提供4个电子,所以丙烯的大π键可以表示为п43。
(4)①氮化镓结构和单晶硅相似,所以处于晶包内部的4个原子的任意一个在平面里的投影恰好落在平面的对角线的1/4处,所以D的原子坐标为(3/4,3/4,3/4) 。②晶胞中实际含有的氮化镓为4个,其质量为4*84g/NA,晶包的体积为(a×10-7)3,所以有(a×10-7)3×d=4*84g/NA,解得NA=336/a3d×1021。


科目:高中化学 来源: 题型:
【题目】氮化铝(AIN)是一种新型无机非金属材料。某AlN样品仅含有趾Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
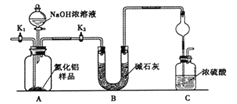
(1)上图C装置中球形干燥管的作用是_____________________。
(2)实验步骤:组装好实验装置,检查好装置气密性再加入实验药品,接下来关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化,通入氮气的目的____________________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见__________________。
【方案2】用如图装置测定mg样品中A1N的纯度(部分夹持装置已略去)。
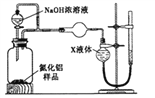
(4)为测定生成气体的体积,量气装置中的X液体不可以是_____________________。
A.NH4Cl溶液 b.CCl4 c.H2O d.苯
(5)若ag样品完全反应,测得生成气体的体积为bmL(已转换为标准状况),则AlN的质量分数是__________。
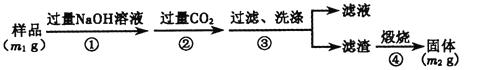
(6)写出步骤中发生的化学反应方程式_______________________________。
(7)若在步骤③中未洗涤,测定结果将______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表的一部分,表中阿拉伯数字(1、2……)是元素周期表中行或列的序号。请参照元素A~I在表中的位置,回答下列问题。
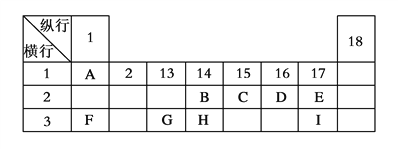
(1)B、C、H三元素中非金属性最强的是________(写出元素名称),写出AF化合物的电子式__________,若AF与水反应产生2.24L气体(标准状况下),则转移电子数目为_______。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子方程式: ____________。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z和M。写出Z与Y反应的化学方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中,铟(In)与铝同主族,与碘同周期。由此推断
A.In最外层有5个电子B.In的原子半径小于I
C.In(OH)3的碱性强于Al(OH)3D.In属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将煤转化为清洁气体燃料:
已知:2H2(g)+ O2(g)=2H2O(g) △H= -483.6kJ/mol
C(s)+1/2O2(g)=CO(g) △H= -110.5kJ/mol
写出焦炭与水蒸气反应制 H2 和 CO 的热化学方程式_____________。
(2)一定条件下密闭容器内,SO2 被氧化成 SO3 的热化学方程式为:2SO2(g)+O2(g)2SO3(g)△H=-a kJ/mo1,在相同条件下要想放出 2akJ 热量,加入各物质的物质的量可能是_______。
A.4mo1 SO2 和 2mol O2 B.2mol SO2、1mo1O2
C.4mol SO2 和 4mo1O2 D.6mo1SO2 和 4mo1O2
(3)汽车尾气中 NOx 和 CO 的生成及转化:
①已知气缸中生成 NO 的反应为:N2(g)+O2(g) ![]() 2NO(g),在一定温度下的定容密闭容器中,能说明此反应已达平衡的是_______。
2NO(g),在一定温度下的定容密闭容器中,能说明此反应已达平衡的是_______。
A.压强不变 B.混合气体平均相对分子质量不变
C.2v 正(N2)=v 逆(NO) D.N2 的体积分数不再改变
②汽车燃油不完全燃烧时产生 CO,有人设想按下列反应除去 CO:2CO(g)=2C(s)+O2(g)△H>0,简述该设想能否实现的依据___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,漂白粉的有效成分是(填化学式)有关化学反应方程式为 .
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 .
(3)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则相同状况下10L O3与L Cl2的消毒能力相当.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表示确的是
A. 原子结构示意图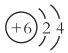 只能表示12C原子
只能表示12C原子
B. 黄钾铁矾[KFe3(SO4)2(OH)6]中,Fe的化合价为+2
C. ![]() 系统命名法为3-丁烯
系统命名法为3-丁烯
D. 甲基的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.传统的无机非金属材料具有抗腐蚀性、耐高温等许多优点,但也有质脆、经不起热冲击的缺点
B.新型无机非金属材料继承了传统非金属材料的优点,但不能耐高温
C.有些新型无机非金属材料可以做绝缘体,但都不能做半导体
D.新型无机非金属材料都能透过可见光
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com