
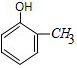
 2-甲基苯酚、
2-甲基苯酚、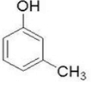 3-甲基苯酚、
3-甲基苯酚、 4-甲基苯酚.
4-甲基苯酚. 分析 (1)根据n=$\frac{m}{M}$计算有机物、二氧化碳、水的物质的量,根据质量守恒判断有机物中是否含有氧元素,若含有氧元素,计算氧原子物质的量,再根据原子守恒计算有机物分子中C、H、O原子数目,进而确定有机物分子式;
(2)若该有机物遇三氯化铁溶液显紫色,则有机物含有苯环和酚羟基,为苯酚,比该有机物多一个碳原子的同系物为甲基苯酚,存在邻、间、对三种结构.
解答 解:(1)0.94g某有机化合物在纯氧中完全燃烧,仅生成2.64g二氧化碳和0.54g水,
0.94g该有机物的物质的量为:$\frac{0.94g}{94g/mol}$=0.01mol,燃烧生成二氧化碳的物质的量为:$\frac{2.64g}{44g/mol}$=0.06mol,燃烧生成水的物质的量为:$\frac{0.54g}{18g/mol}$=0.03mol,
故m(C)+m(H)=0.06mol×12g/mol+0.03mol×2×1g/mol=0.78g<0.94g,故有机物含有O元素,0.94g有机物含有m(O)=0.94g-0.78g=0.16g,n(O)=$\frac{0.16g}{16g/mol}$=0.01mol,
则有机物分子中N(C)=$\frac{0.06mol}{0.01mol}$=6、N(H)=$\frac{0.03mol×2}{0.01mol}$=6、N(O)=$\frac{0.01mol}{0.01mol}$=1,该有机物分子式为:C6H6O,
故答案为:C6H6O;
(2)该有机物的分子式为C6H6O,有机物遇三氯化铁溶液显紫色,则有机物含有苯环和官能团酚羟基:-OH,该有机物为苯酚,该有机物的结构简式为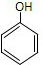 ,比该有机物多一个碳原子的同系物中含有1个酚羟基和1个甲基,为甲基苯酚,可能结构简式和名称分别为:
,比该有机物多一个碳原子的同系物中含有1个酚羟基和1个甲基,为甲基苯酚,可能结构简式和名称分别为: 2-甲基苯酚、
2-甲基苯酚、 3-甲基苯酚、
3-甲基苯酚、 4-甲基苯酚,
4-甲基苯酚,
故答案为: 2-甲基苯酚、
2-甲基苯酚、 3-甲基苯酚、
3-甲基苯酚、 4-甲基苯酚.
4-甲基苯酚.
点评 本题考查有机物分子式、结构简式的确定方法,题目难度中等,注意掌握确定常见有机物分子式、结构简式的方法,根据质量守恒定律确定氧元素为解题关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
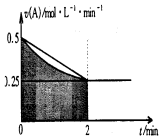
| A. | 0-2min,速率不断减少的主要原因是A的浓度减少 | |
| B. | 反应开始前2min,C的浓度增加量等于A的浓度减少量 | |
| C. | 至2min时,A的物质的量减小值可能是0.5mol | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发水分的方法使海水中的盐析出 | |
| B. | 用加热蒸馏的方法,从工业酒精中获得95.6%的乙醇 | |
| C. | 用加热升华的方法把单质碘从它和碘化钾固体形成的混合物中分离出来 | |
| D. | 用加热的方法,把掺杂在NaCl固体中的少量NH4HCO3固体除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收汽车尾气中的NO2:2NO2+2OH-═NO3-+NO↑+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+2H2O═2Al(OH)3↓+HCO3- | |
| C. | 澄清石灰水和硝酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 向Na2SO3溶液中加人过量酸性KMnO4溶液:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
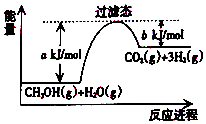 参考如图,按要求回答下列问题:
参考如图,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
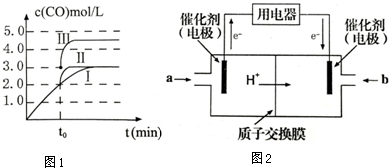
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 光照射甲烷和氯气的混合气体 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍作催化剂条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com