
| A. |  | B. |  | C. |  | D. |  |
科目:高中化学 来源: 题型:选择题
| A. | 墨水是一种胶体,不同墨水混用时可能使钢笔流水不畅或者堵塞 | |
| B. | 持续加热到一定温度能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 洁厕液与84消毒液混合洗厕所可以达到洗涤和消毒杀菌的双重功效,对人体不可能造成伤害 | |
| D. | 用13C示踪原子法可以进行幽门螺旋杆菌的精确检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
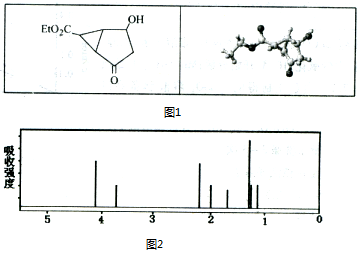
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生加成反应、取代反应,但不能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
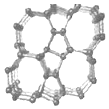
| A. | Si24是一种新型化合物 | |
| B. | Si24是硅的一种同素异形体 | |
| C. | Si24易与稀硫酸反应生成氢气 | |
| D. | 硅太阳能电池供电原理与原电池相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸 | |
| C. | R、X、Y三者的气态氢化物稳定性依次增强 | |
| D. | Z的单质能与Y的某些化合物发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.8 g | B. | 19.2 g | C. | 32.0 g | D. | 38.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
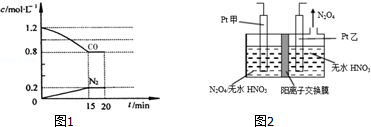
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质熔点 Al>Mg>K>Na>Li | B. | 沸点 HI>HBr>HCl>HF | ||
| C. | 酸性 HClO4>H2SO4>H3PO4>H2SiO3 | D. | 稳定性 AsH3>PH3>NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com