
 ;咖啡酸苯乙酯的键线式结构简式为
;咖啡酸苯乙酯的键线式结构简式为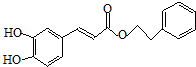 .
.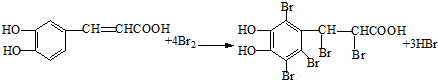 .
.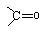
 的芳香化合物共有3种
的芳香化合物共有3种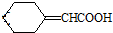 .
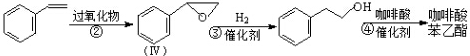
. 分析 (1)根据化合物Ⅰ的结构简式写分子式,反应③催化加氢;
(2)按说明写Ⅱ的结构简式,反应④是酯化反应,根据反应原理写反应产物结构;
(3)足量的溴水与咖啡酸发生加成和苯环上的取代反应;
(4)A.化合物Ⅰ有醛基,所以能发生银镜反应;
B.苯乙烯发生加聚反应生成线型热塑型塑料;
C.苯乙醇能被酸性高锰酸钾氧化,所以能使其褪色;
D.镍催化下,咖啡酸中有一个苯环可以加成3个氢分子,还有一个碳碳双键可以加成一个氢分子,所以1mol咖啡酸最多可加成4molH2;
E.根据化合物Ⅳ的结构,可写出含有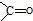 的芳香化合物的结构,并判断;
的芳香化合物的结构,并判断;
(5)根据题目信息中的反应原理推知产物结构简式;
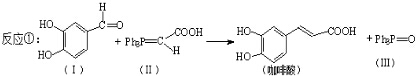
解答 解:(1)根据化合物Ⅰ的结构简式可知,其分子式为C7H6O3,反应③催化加氢,所以是还原反应(加成反应),
故答案为:C7H6O3;还原反应(加成反应);
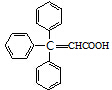
(2)若化合物Ⅱ和Ⅲ中的“Ph”为苯基、“P”为磷原子,则化合物Ⅱ的结构简式为  ;咖啡酸苯乙酯的键线式结构简式为
;咖啡酸苯乙酯的键线式结构简式为  ,
,
故答案为: ;
; ;
;
(3)足量的溴水与咖啡酸发生反应的化学方程式为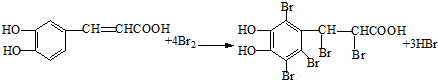 ,
,
故答案为: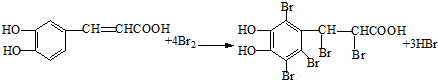 ;
;
(4)A.化合物Ⅰ有醛基,所以能发生银镜反应,故正确;
B.苯乙烯发生加聚反应生成塑料,故正确;
C.苯乙醇能被酸性高锰酸钾氧化,所以能使其褪色,故正确;
D.镍催化下,咖啡酸中有一个苯环可以加成3个氢分子,还有一个碳碳双键可以加成一个氢分子,所以1mol咖啡酸最多可加成4molH2,故正确;
E.根据化合物Ⅳ的结构,可知含有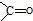 的芳香化合物的结构为苯环上连有一个侧链为-COCH3或-CH2CHO,也可以是两个侧链为-CHO、-CH3,有邻间对三种,所以共有5种,故E错误;
的芳香化合物的结构为苯环上连有一个侧链为-COCH3或-CH2CHO,也可以是两个侧链为-CHO、-CH3,有邻间对三种,所以共有5种,故E错误;
故选E;
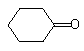
(5)环己酮(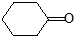 )与化合物Ⅱ也能发生反应①的反应,根据元素守恒可知其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,根据元素守恒可知其生成含羧基的化合物的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与性质,注意根据转化关系中有机物的结构进行推断,对学生的逻辑推理有一定的要求,能较好的考查学生对知识的迁移运用,是对学生综合能力的考查,难度中等,


科目:高中化学 来源: 题型:选择题
| A. | 固体中无FeCl2 | B. | ③中使KMnO4褪色的是NO2- | ||
| C. | G的pH>7 | D. | 固体由Ba(OH)2?AlCl3?Na2SO3组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
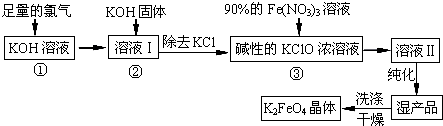
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2gFe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜是一种新型单质 | |
| B. | 纳米铜颗粒比普通铜更难与氧气发生反应 | |
| C. | 纳米铜与普通铜所含铜原子的种类相同 | |
| D. | 纳米铜无需密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
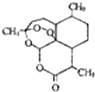 青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )
青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )| A. | 易溶于乙醚等有机溶剂 | B. | 分子式为C15H21O5 | ||
| C. | 能在热的NaOH溶液中存在 | D. | 分子结构中含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
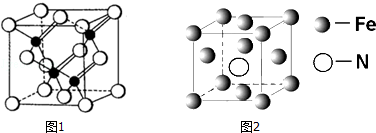
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com