


| 实验步骤 | 现象 | 结论 |
______ | ______ | H2SO3酸性强于H2CO3 |
| 实验步骤 | 现象 | 结论 |
| 将SO2依次通过 NaHCO3或Na2CO3溶液、 酸性KMnO4溶液、 品红溶液、 澄清石灰水 | NaHCO3或Na2CO3溶液有气泡, 品红溶液不褪色, 澄清石灰水变浑浊 | H2SO3酸性强于H2CO3 |


科目:高中化学 来源: 题型:阅读理解
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 现象 | 结论 |
将SO2依次通过 NaHCO3或Na2CO3溶液、 酸性KMnO4溶液、 品红溶液、 澄清石灰水 将SO2依次通过 NaHCO3或Na2CO3溶液、 酸性KMnO4溶液、 品红溶液、 澄清石灰水 |
NaHCO3或Na2CO3溶液有气泡, 品红溶液不褪色, 澄清石灰水变浑浊 NaHCO3或Na2CO3溶液有气泡, 品红溶液不褪色, 澄清石灰水变浑浊 |
H2SO3酸性强于H2CO3 |
查看答案和解析>>
科目:高中化学 来源:山东省高考真题 题型:推断题






查看答案和解析>>
科目:高中化学 来源: 题型:
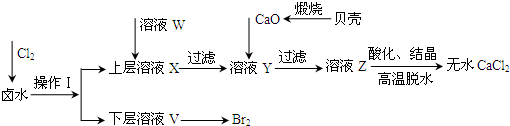
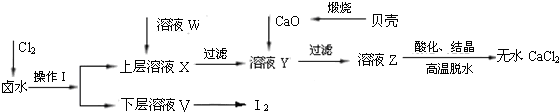
实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:

(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_______。
(2)加入溶液W的目的是______。用CaO调节溶液Y的pH,可以除去Mg2+。酸化溶液Z时,使用的试剂为_____。
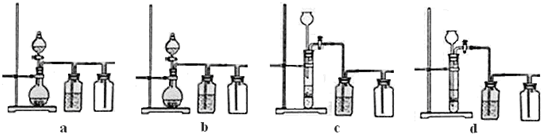
(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是______。

(4)工业规模海水提溴常用空气吹出法将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,请写出该反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com