
【题目】随着工业的迅速发展,废水的种类和数量迅猛增加,对水体的污染也日趋广泛和严重,威胁人类的健康和安全.因此工业废水的处理是当代一个重要的课题.

![]() 臭氧是一种强氧化剂,在处理含氰
臭氧是一种强氧化剂,在处理含氰![]() 废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:
废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:![]()
总反应的化学方程式为 ______ ,该反应![]() ______ .
______ .
![]() 工业含磷废水中含大量的
工业含磷废水中含大量的![]() ,可通过投放镁盐进行除磷.
,可通过投放镁盐进行除磷.
![]() 投放的镁盐让磷酸根形成
投放的镁盐让磷酸根形成![]() 沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是 ______
沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是 ______ ![]() 当pH较高时,磷去除率下降的原因是 ______ .
当pH较高时,磷去除率下降的原因是 ______ .
![]() 若处理后的废水中
若处理后的废水中![]() 时,试计算溶液中的
时,试计算溶液中的![]() 写出计算过程,已知
写出计算过程,已知![]()
![]() 若废水中还含有大量的
若废水中还含有大量的![]() ,投放镁盐,可得到磷酸氨镁晶体
,投放镁盐,可得到磷酸氨镁晶体![]() ,可用作化肥.写出该反应的离子方程式 ______ .
,可用作化肥.写出该反应的离子方程式 ______ .
![]() 实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知
实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知![]() 时,
时,![]() 反应时间t的变化曲线如图
反应时间t的变化曲线如图![]() 若保持其他条件不变,请在坐标图中,画出
若保持其他条件不变,请在坐标图中,画出![]() 时
时![]() 反应时间t的变化曲线示意图。
反应时间t的变化曲线示意图。
【答案】![]()
![]()
![]()
![]() 与
与![]() 反应生成更难溶的
反应生成更难溶的![]()
![]()
【解析】
![]() 据盖斯定律,将所给的三个反应:
据盖斯定律,将所给的三个反应:![]() 可得总反应以及
可得总反应以及![]() ;
;
![]() 根据图可知,去除率较大时所对应的pH值即是;根据
根据图可知,去除率较大时所对应的pH值即是;根据![]() 与
与![]() 反应生成更难溶的
反应生成更难溶的![]() ;
;
![]() 根据
根据![]() 计算;
计算;
![]() 根据题目信息书写方程式,注意电荷守恒;
根据题目信息书写方程式,注意电荷守恒;
![]() 根据温度越高,反应速率增大,残余磷浓度越高,画出
根据温度越高,反应速率增大,残余磷浓度越高,画出![]() 时
时![]() 反应时间t的变化曲线示意图。
反应时间t的变化曲线示意图。
![]() 将所给的三个反应:
将所给的三个反应:![]() 可得总反应以及
可得总反应以及![]() ,
,![]()
故答案为:![]() ;
;![]() ;
;
![]() 从如图可知,pH在
从如图可知,pH在![]() 为除磷的最佳范围;当pH较高时,磷去除率下降的原因是
为除磷的最佳范围;当pH较高时,磷去除率下降的原因是![]() 与
与![]() 反应生成更难溶的
反应生成更难溶的![]() ;
;
故答案为:![]() ;
; ![]() 与
与![]() 反应生成更难溶的
反应生成更难溶的![]() ;
;
![]() ,即
,即![]() ,
,![]() ;
;
故答案为:![]() ;
;
![]() 废水中还含有大量的
废水中还含有大量的![]() ,投放镁盐,可得到磷酸氨镁晶体
,投放镁盐,可得到磷酸氨镁晶体![]() ,方程式为:
,方程式为:![]() ;
;
古答案为:![]() ;
;
![]() 温度越高,反应速率增大,残余磷浓度越高,则
温度越高,反应速率增大,残余磷浓度越高,则![]() 时
时![]() 反应时间t的变化曲线示意图为
反应时间t的变化曲线示意图为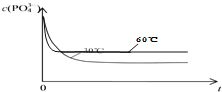 ;
;
故答案为: ;
;


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.煤、石油、天然气属于不可再生能源
B.地球上最基本的能源是太阳能,大自然利用太阳能最成功的是植物的光合作用
C.![]() 是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
D.通过煤的气化、液化等方法将煤转化为CO、![]() 等燃料,可以提高煤燃烧的热效率
等燃料,可以提高煤燃烧的热效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为50%
C. 2min内A的反应速率为0.3mol·L-1·min-1
D. 若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.反应:![]() 在温度为298K时能自发进行,则它的
在温度为298K时能自发进行,则它的![]() ,
,![]()
B.![]()
![]() 溶液加蒸馏水稀释,溶液的pH不断减小
溶液加蒸馏水稀释,溶液的pH不断减小
C.铅蓄电池放电时,正极和负极的质量均增加
D.恒温恒容条件下可逆反应:![]() ,达平衡后,若向平衡体系中加入一定量的A,新平衡体系中,B的物质的量分数一定不变
,达平衡后,若向平衡体系中加入一定量的A,新平衡体系中,B的物质的量分数一定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是![]()
A.![]() 标准状况
标准状况![]() 和NO的混合物中含有的分子数为
和NO的混合物中含有的分子数为![]()
B.1mol羟基与1mol氢氧根离子含有的电子数均为![]()
C.![]() g
g![]() 完全水解形成的
完全水解形成的![]() 胶体粒子数为
胶体粒子数为![]()
D.42g乙烯和丁烯的混合物中含有的极性共价键数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究发现硼氢化钠(NaBH4)在催化剂Ru表面与水反应可生成H2,其反应机理如图所示:

根据以上信息判断,下列叙述错误的是
A.过程①至过程④中硼元素的化合价不变
B.X是H3BO3,H3BO3和BH3两分子中H的化合价相等
C.过程③和过程④各产生1molH2时转移的电子数不相等
D.0.25molNaBH4的还原能力与标准状况下22.4LH2的还原能力相当(还原能力即生成H+失去电子的量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质和非电解质是对化合物的一种分类方式。下列关于电解质的说法正确的是( )
A. 液态HCl不导电,所以HCl不是电解质
B. CO2溶于水形成的溶液能导电,所以CO2是电解质
C. SO2溶于水能导电,所以SO2是电解质
D. BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。下列叙述正确的是( )

A. HA为弱酸,MOH为强碱
B. 水的电离程度:X>Y=Z
C. 若升高温度,Y、Z点对应溶液的pH均减小
D. 将Y点与Z点对应溶液以体积比为1:10混合,所得溶液中:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com