
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
A.x的转化率变小 B.(a+b)>(c+d)
C.z的体积分数变大 D.平衡向正反应方向移动
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:填空题
(15分)已知乙烯能发生以下转化:
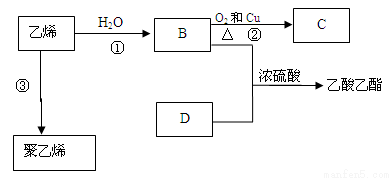
(1)乙烯的结构式为: 。
(2)写出化合物官能团的化学式及名称:
B中含官能团名称 ;D中含官能团名称 ;
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型:
③: 反应类型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:填空题
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+ O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。
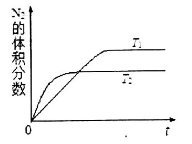
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。

①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃 料电池,可用作电解池的电源。其工作原理如图所示
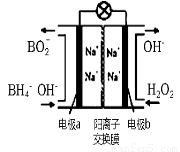
①写出a极上的电极反应式: ,
②正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g) ==2H2O(g) ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1
B.若C(石墨,s) ===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=—57.4 kJ·mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g) ===2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
已知在100 ℃的温度下,水的离子积Kw=1×10-12,本题涉及的溶液温度均为100 ℃。下列说法中正确的是
A.0.001 mol·L-1的H2SO4溶液,pH=2
B.0.001 mol·L-1的NaOH溶液,由水电离出来的C(H+)=1×10-11 mol·L-1
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=9的NaOH溶液50 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
根据相关化学知识分析,下列推断正确的是
A.若X原子中的质子数为a,中子数为b,则X的质量数为:a-b
B.若弱酸HA的酸性强于弱酸HB,则同物质的量浓度钠盐溶液的碱性比较为:NaA<NaB
C.若R2-和M+的电子层结构相同,则原子序数的比较为:R>M
D.若反应A2+2D—==2A-+D2能发生,则氧化性的比较为:D2>A2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
方程式中正确的是
A.向碳酸氢钙溶液中加入过量氢氧化钠 :Ca2++2HCO
:Ca2++2HCO +2OH-
+2OH- CaCO3↓+CO
CaCO3↓+CO +2H2O
+2H2O
B.氧化铁可溶于氢碘酸:Fe2O3+6H+ 2Fe3++3H2O
2Fe3++3H2O
C.Fe3+的检验:Fe3++3SCN- Fe(SCN)3↓
Fe(SCN)3↓
D.(NH4)2Fe(SO4)2溶液与过量的NaOH溶液反应:Fe2++2OH- Fe(OH)2↓
Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C、与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| D、c(H+)/c(OH-)=1×10-13的溶液K+、Na+、CH3COO-,Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com