
800℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应
CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
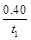 mol/(L·min)
mol/(L·min)BC
解析试题分析:A.v(CO)=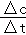 =
=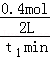 =
=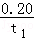 mol/(L?min),则v(H2)=
mol/(L?min),则v(H2)=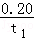 mol/(L?min),故A错误;B.t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,故B错误;C..保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C正确;D.t1min时反应已经达到平衡状态,此时c(CO)=
mol/(L?min),故A错误;B.t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,故B错误;C..保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C正确;D.t1min时反应已经达到平衡状态,此时c(CO)=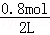 =0.4mol/L,c(H2O)=
=0.4mol/L,c(H2O)=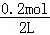 =0.1mol/L,c(CO2)=c(H2)=
=0.1mol/L,c(CO2)=c(H2)=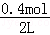 =0.2mol/L,则k=
=0.2mol/L,则k=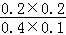 =1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;故选C.。
=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;故选C.。
考点:本题主要考查化学平衡问题,主要考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变 |
| B.0.1mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
C.对于N2(g)+3H2(g) 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 |
| D.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液 |
| B.催化剂可以加快化学反应速率但不能改变化学反应的焓变 |
| C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
D.对于反应2SO2(g)+O2(g) 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,对可逆反应A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是
A.单位时间内消耗amolA,同时生成3amolC
B.混合气体的物质的量不再变化
C.2v(C)正=3v(B)逆
D.容器内的压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( )。
2Z(g)一定达到化学平衡状态的是( )。
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com