
| A.KCl | B.CaCl2 | C.BaCl2 | D.NaCl |
 ="29" g×
="29" g×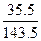 ="7.17" g
="7.17" g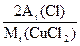 ="13.5" g×
="13.5" g×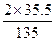 ="7.1" g
="7.1" g

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:填空题
 。请填空:
。请填空:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA |
| B.32 g氧气所含原子数目为NA |
| C.在25 ℃,压强为1.01×105 Pa时,11.2 L氮气所含的原子数目为NA |
| D.17 g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶1 | B.1∶2 | C.2∶1 | D.4∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.MnO2+4HCl MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
B.2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑ 2KCl+2MnCl2+5Cl2↑ |
C.KClO3+6HCl KCl+3Cl2↑+3H2O KCl+3Cl2↑+3H2O |
D.2HCl(aq)  H2↑+Cl2↑ H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.6.02×1023 | B.3.01×1023 |
| C.2.408×1023 | D.4.816×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.21.2 g | B.20.6 g | C.19.4 g | D.19.6 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
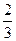 。假设溶质不外泄,则所得溶液的物质的量浓度为_________________________。
。假设溶质不外泄,则所得溶液的物质的量浓度为_________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com