
在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp)
)=(Ksp)
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO
)=Ksp,c(Ba2+)>c(SO )
)
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO
)>Ksp,c(Ba2+)=c(SO )
)
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO
)≠Ksp,c(Ba2+)<c(SO )
)
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
A.3 mol NF3与水完全反应生成HNO3和NO,转移电子数2 NA
B.标准状况下,32 g硫(结构见图)含SS的数目为2 NA
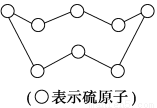
C.标准状况下11.2 L正戊烷所含共用电子对数为8NA
D.含a mol·L-1 H+的醋酸溶液稀释10倍后,H+为0.1aNA
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:填空题
(1)合成氨反应的热化学方程式:N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。
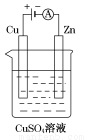
①锌片上发生的电极反应式是:_______________________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
如图为某反应的焓变示意图,下列有关该反应的说法中正确的是( )
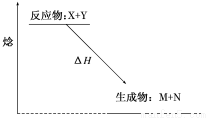
A.ΔH>0
B.X能量一定高于M
C.该反应为放热反应
D.该反应一定不必加热就可以发生
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:填空题
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA-,HA- H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性”“中性”或“碱性”),用离子方程式表示其原因
__________________________________________________
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是________。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能
______(填“>”、“<”或“=”)0.11 mol·L-1;理由是____________________________
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①________②(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
下图中,表示2A(g)+B(g)  2C(g)(正反应放热)。这个可逆反应的正确图像为( )
2C(g)(正反应放热)。这个可逆反应的正确图像为( )
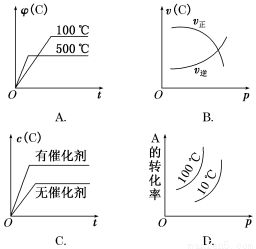
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
A.H2与F2反应的热化学方程式为:
H2(g)+F2(g)=2HF(g) ΔH=-541 kJ
B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量
C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ
D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
氨水中存在下列的电离平衡:NH3·H2O NH
NH +OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
+OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
A.NaOH固体 B.NH4Cl固体
C.H2SO4 D.H2O
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:选择题
[双选题]上海人张霞昌在芬兰发明了“纸电池”,这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,纸内的离子“流过”水和氧化锌组成的电解质溶液,电池总反应式为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是( )
A.该电池的负极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-
D.当有0.1 mol锌溶解时,流经电解质溶液的电子数为1.204×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com