
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
| 1 |
| 0.5 |
| 4×23 |
| 62 |
| 8 |
| 9 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
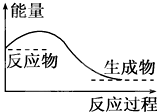
| A、任何化学反应都伴随着能量的变化 |
| B、H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化 |
| C、化学反应中能量的变化都表现为热量的变化 |
| D、对于如图所示的过程,是吸收能量的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).查看答案和解析>>
科目:高中化学 来源: 题型:
A、1-
| ||||
B、1-
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中存在Fe3+和Fe2+ |
| B、1.12L气体是NO、NO2的混合气体 |
| C、反应后溶液中c(NO3-)=0.85mol?L-1 |
| D、反应后的溶液最多还能溶解1.4g Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com