
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L(以标准状况)
【知识点】守恒法用于氧化还原反应计算 C2 C3 B3
【答案解析】C 解析:生成沉淀的质量比原合金的质量增加5.1g,说明OH—质量为5.1g,即0.3mol,金属结合氢氧根离子的物质的量与反应转化的电子的物质的量相等,所以反应转化的电子为0.3mol,生成的NO为0.1mol,根据氮原子守恒计算参加反应的硝酸的物质的量为0.4mol,故C正确;消耗NaOH溶液体积应为100mL,B错误;产生NO气体体积标况下应为2.24L,D错误;根据电荷守恒,镁、铜合金共0.15 mol,用极端假设法,如果全部是铜,质量为9.6g,所以合金质量应比9.6g小,A错误。
故答案选C
【思路点拨】本题考查了守恒法用于氧化还原反应计算,解题的关键是利用生成沉淀的质量比原合金的质量增加5.1g,即0.3mol,得到反应转化的电子为0.3mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、B两种有机物,分子式都是C9H11O2N。
(1)化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在—CH3,化合物A的结构简式为
________________________________________________________________________。
(2)化合物B是某种分子式为C9H12的芳香烃一硝化后的唯一产物(硝基连在苯环上)。化合物B的结构简式为
________________________________________________________________________。
(3)两分子A可形成含有六元环的物质C,则C的结构简式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题。
(1) 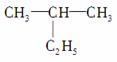 命名为“2乙基丙烷”,错误原因是____________________;将
命名为“2乙基丙烷”,错误原因是____________________;将
其命名为“3甲基丁烷”,错误原因是__________________。正确的命名为________。
(2)  的名称是________________。
的名称是________________。
(3)2,6二甲基4乙基辛烷的结构简式是______________________,1 mol该烷烃完全燃烧需消耗氧气______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO
 Cr2O
Cr2O
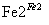 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O )=v(CrO
)=v(CrO )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是 ( )
A.2Na218O2 + 2H2O = 4Nal8OH + O2↑
B.NH4Cl + 2H2O  NH3·2H2O + HCl
NH3·2H2O + HCl
C.2KMnO4 + 5H218O2 + 3H2SO4= K2SO4 + 2MnSO4 + 518O2↑ + 8H2O
D.K37ClO3 + 6HCl = K37Cl + 3Cl2↑ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
从硫化物中提取单质锑,经历以下两个过程: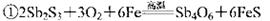
②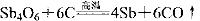 关于反应①、②的说法不正确的是
关于反应①、②的说法不正确的是
A.反应①中Sb元素被氧化
B.反应②中Sb元素被还原
C.标准状况下,每生成4 mol Sb时,消耗67.2LO2
D.反应②说明高温下C的还原性比Sb强
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均是短周期元素,A和B同周期,A和C同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,E是所在周期中原子半径最小的元素,请回答。
(1)C在元素周期表中的位置是_______.
(2)D2B的电子式是___________;AB2的结构式是____________.
(3)B、D、E离子半径的由大到小的顺序为___________;(用离子符号回答)A、C、E最高价氧化物对应水化物的酸性由强到弱的顺序为_________.(用化学式回答)
(4)A、B气态氢化物沸点高的是___________;(用化学式回答)原因_____________.
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生以为,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀,当消耗13.50g EB2时,共转移了1mol电子,则反应的离子方程式为_________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com