
【题目】富马酸(反式丁烯二酸)可用于制备聚酯树脂、医药等。实验室以石油的裂解产物之一A为原料制备富马酸及其衍生物的一种工艺路线如下:

已知:链烃A的核磁共振氢谱中有2组吸收峰。
(1)A的化学名称为________,B的结构简式为__________。
(2)③的反应类型为________.检验E中含氧官能团所用的试剂为___________。
(3)反应④的化学方程式为___________。
(4)反应⑧的化学方程式为______________。
(5)富马酸的同分异构体中,同为二元羧酸的还有__________(包括顺反异构)。
(6)已知:  ,参照上述合成路线,以
,参照上述合成路线,以![]() 为原料( 无机试剂任选).设计制备
为原料( 无机试剂任选).设计制备![]() 的合成路线:_____________________。
的合成路线:_____________________。
【答案】 1,3-丁二烯 ![]() 加成反应 银氨溶液或新制Cu(OH)2溶液
加成反应 银氨溶液或新制Cu(OH)2溶液 
![]()

 或
或
【解析】链烃A的核磁共振氢谱中有2组吸收峰,分子式为C4H6,故高度对称,应该含有两个碳碳双键,为CH2=CHCH=CH2,CH2=CHCH=CH2与氯气发生加成反应,生成分子式为C4H6Cl2的B,结构后面物质的结构可知发生的是1,4-加成,生成B为ClCH2CH=CHCH2Cl;ClCH2CH=CHCH2Cl在氢氧化钠的水溶液中加热发生水解反应生成C为HOCH2CH=CHCH2OH;为避免碳碳双键被氧化,必须先保护后再将醇羟基氧化为醛基,则HOCH2CH=CHCH2OH与氯化氢发生加成反应生成D为HOCH2CH2CHClCH2OH,HOCH2CH2CHClCH2OH催化氧化得到E为OHCCH2CHClCHO;OHCCH2CHClCHO氧化得到 ,
, 在氢氧化钠的醇溶液中发生消去反应后酸化得到富马酸,富马酸发生加聚反应生成G为
在氢氧化钠的醇溶液中发生消去反应后酸化得到富马酸,富马酸发生加聚反应生成G为 ;
; 与甲醇在浓硫酸催化下发生酯化反应生成H为
与甲醇在浓硫酸催化下发生酯化反应生成H为 。(1)A为CH2=CHCH=CH2,化学名称为1,3-丁二烯,B的结构简式为ClCH2CH=CHCH2Cl;(2)③是HOCH2CH=CHCH2OH与氯化氢发生加成反应生成HOCH2CH2CHClCH2OH,反应类型为加成反应;检验E(OHCCH2CHClCHO)中含氧官能团醛基所用的试剂为银氨溶液或新制Cu(OH)2溶液;(3)反应④是HOCH2CH2CHClCH2OH在铜的催化下与氧气反应生成OHCCH2CHClCHO,反应的化学方程式为
。(1)A为CH2=CHCH=CH2,化学名称为1,3-丁二烯,B的结构简式为ClCH2CH=CHCH2Cl;(2)③是HOCH2CH=CHCH2OH与氯化氢发生加成反应生成HOCH2CH2CHClCH2OH,反应类型为加成反应;检验E(OHCCH2CHClCHO)中含氧官能团醛基所用的试剂为银氨溶液或新制Cu(OH)2溶液;(3)反应④是HOCH2CH2CHClCH2OH在铜的催化下与氧气反应生成OHCCH2CHClCHO,反应的化学方程式为 ;(4)反应⑧是
;(4)反应⑧是 与甲醇在浓硫酸催化下发生酯化反应生成
与甲醇在浓硫酸催化下发生酯化反应生成 ,反应的化学方程式为
,反应的化学方程式为![]() ;(5)富马酸的同分异构体中,同为二元羧酸的还有
;(5)富马酸的同分异构体中,同为二元羧酸的还有 ;(6)已知:
;(6)已知:  ,参照上述合成路线,
,参照上述合成路线,![]() 发生臭氧氧化得到
发生臭氧氧化得到![]() ,
,![]() 发生银镜反应后酸化或与新制的氢氧化铜反应后酸化得到
发生银镜反应后酸化或与新制的氢氧化铜反应后酸化得到![]() ,
,![]() 在氢氧化钠的醇溶液中发生消去反应后再酸化得到
在氢氧化钠的醇溶液中发生消去反应后再酸化得到![]() ,合成路线为
,合成路线为 或
或 。
。


科目:高中化学 来源: 题型:
【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示(已知CuO 可以作为碳氢化合物燃烧的催化剂):

(1)若A装置中所盛放的药品是浓NaOH 溶液,装置A的作用有:
①______________________________;②______________________________.
(2)C装置中所盛放的药品是无水CaCl2或P2O5,作用是___________________________.
(3)D装置中所盛放的药品是浓NaOH溶液,作用是________________________________.
(4)E装置中所盛放的药品是_________,作用是__________________________________.
(5)上述装置中有一处错误,请按要求填写下表(不考虑酒精灯和加热方法可能存在的错误;若增加仪器和药品,请指明仪器、药品名称和位置):
错误原因 | __________________________________ |
改正方法 | __________________________________ |
(6)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品+U形管的质量/g | 101.1 | 102.9 |
药品+广口瓶D的质量/g | 312.0 | 314.2 |
则该气体中碳和氢两种元素的质量比为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是
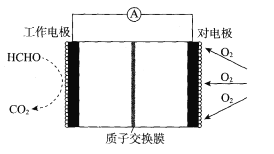
A. 传感器工作时,工作电极电势高
B. 工作时,H+通过交换膜向工作电极附近移动
C. 当导线中通过1.2×l0-6 mol电子,进入传感器的甲醛为3×10-3 mg
D. 工作时,对电极区电解质溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Fe3+、Fe2+、Cu2+的溶液中加入铁粉,充分反应后,固体残渣用盐酸处理有气体放出,则与铁粉反应后的溶液中最多的离子是
A.Fe3+B.Fe2+C.Cu2+D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是
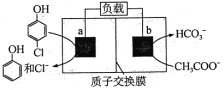
A. a、b极不能使用同种电极材料
B. 工作时,a极的电势低于b极的电势
C. 工作一段时间之后,a极区溶液的pH增大
D. b极的电极反应式为:CH3 COO-+4H2O-8e-=2HCO3-+9H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是
A. 上述反应中,反应物的总能量低于生成物的总能量
B. 若升高温度,则k(正)增大,k(逆)减小
C. 在上述反应中,反应级数:m=2,n=1
D. 在一定温度下,NO、H2的浓度对正反应速率影响程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
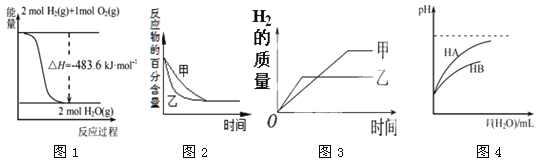
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl2通入水中: Cl2+H2O=2H++Cl-+ClO-
B. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
C. 明矾溶于水产生Al(OH)3胶体:A13++3H2O=Al(OH)3↓+3H+
D. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 过氧化钠与水反应生成0.1mol氧气时,转移的电子数为0.2NA
B. 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
C. 相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
D. 标准状况下,11.2L N2和O2的混合气体中所含的原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com