
 ,
, ;
;

科目:高中化学 来源: 题型:
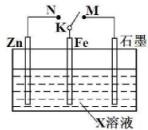
| A、若X为NaCl,K与M相连时,石墨电极反应为2Cl--2e-═Cl2↑ |
| B、若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C、若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D、若X为NaCl,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
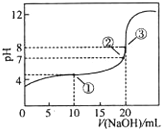 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )| A、该中和滴定过程,最宜用石蕊作指示剂 |
| B、图中点②所示溶液中,c(CH3COO-)=c(Na+) |
| C、图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D、滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
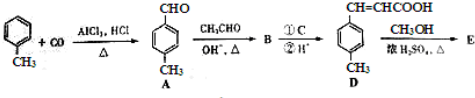
| OH-,△ |
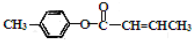 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
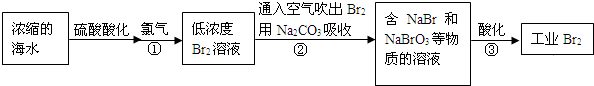
查看答案和解析>>
科目:高中化学 来源: 题型:
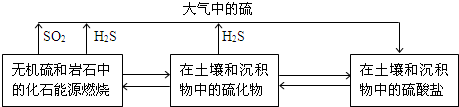
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
| D、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B与A只能形成化合物BA3 |
| B、C的原子半径、离子半径均分别小于D的原子半径、离子半径 |
| C、A、B、C形成的化合物可能促进水的电离,也可能抑制水的电离 |
| D、A、D均能与C形成原子个数比为1:1、2:1的化合物,且A2C2与D2C2的化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com