
| A. |  可回收物 | B. |  电池 | C. |  厨余垃圾 | D. |  其他垃圾 |
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的质量 | |
| B. | 摩尔是国际单位制七个基本单位之一 | |
| C. | 摩尔是粒子的数量单位 | |
| D. | 阿伏伽德罗常数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | CuO | C. | CuSO4•5H2O | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (Ⅰ)取氯化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (Ⅱ)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O |
| 实验二 | (Ⅰ)取实验一得到的溶液,加入KSCN溶液. (Ⅱ)再加入少量H2O2溶液. | 颜色无明显变化 溶液变红,有少量气泡 |
| 实验三 | (Ⅰ)取10mL 0.1mol/L KI溶液,滴加6滴0.1mol/L FeCl3溶液. (Ⅱ)取少量上述黄色溶液,滴加KSCN溶液. (Ⅲ)另取上述的黄色溶液,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (Ⅰ)向实验三步骤I中所得的黄色溶液中加入2mL CCl4,充分振荡后,分离得到水层;重复操作三次. (Ⅱ)向步骤I中所得水层中加入KSCN溶液. | 颜色无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国规定商家不得无偿提供塑料袋,目的是减少“白色污染” | |
| B. | 乙醇是一种易燃烧污染小的可再生能源,但只能在实验室内作燃料 | |
| C. | 化石燃料不可再生,使用太阳能代替化石燃料,有利于节约资源、保护环境 | |
| D. | 积极开发废电池的综合利用技术,防止其中的重金属盐对土壤和水源造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学利用图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
某同学利用图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )| X气体 | Y试剂 | Z试剂 | |
| A. | NO2 | H2O | H2O |
| B. | CO2 | H2O | H2O |
| C. | HCl | 饱和食盐水 | 水 |
| D. | NO2和O2 | H2O | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
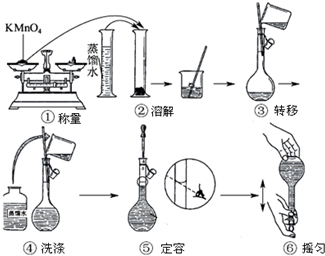
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,可用玻璃棒搅拌漏斗中的液体以加快过滤速率 | |
| B. | 用湿润的pH试纸测溶液的pH,因溶液被稀释而使测量值变大 | |
| C. | 酸碱滴定管、容量瓶、分液漏斗使用前必须检查是否漏水 | |
| D. | 酸碱滴定实验中,需用待滴定溶液润洗锥形瓶以减小实验误差 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com